C60以其完美的球形结构受到科学家的高度重视 从此掀起了球形分子的研究热潮。继C60后 科学家又合成
| C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮。继C60后,科学家又合成了Si60、N60等球形分子。 (1)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为 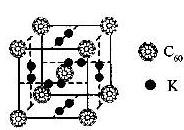 (2)Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 (3)写试出C60、Si60、N60熔点由高到低的顺序为 ,破坏这三种分子所需要的能量顺序为 |
参考解答
| (1)3:1 (2)30 (3) Si60>N60> C60、 N60>C60>Si60 |
试题分析:(1)根据晶胞可知,K原子的个数是6×1/2=3个,而C60分子的个数8×1/8=1个,所以该物质的K原子和C60分子的个数比为3:1。 (2)根据题意,每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构。显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30。 (3) C60、Si60、N60形成的晶体都是分子晶体,熔点高低和相对分子质量大小有关系,所以熔点高到低的顺序为Si60>N60> C60。破坏这三种分子需要破坏共价键,所以所需要的能量顺序为N60>C60>Si60。 点评:该题是高考中的常见题型和考点,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力、自学能力和知识的迁移能力,提高学生灵活运用基础知识解决实际问题的能力。 |
相似问题
下列图式表示的是石墨 氯化钠 干冰 金刚石四种晶体中微粒的排列方式则这四种物质中对应熔点最低的排列方
下列图式表示的是石墨、氯化钠、干冰、金刚石四种晶体中微粒的排列方式则这四种物质中对应熔点最低的排列方式是A.XB.YC.ZD.W
有关晶体结构的叙述中 错误的是( )A.金刚石的网状结构中 最小的环上有6个碳原子B.分子晶体熔化
有关晶体结构的叙述中,错误的是( )A.金刚石的网状结构中,最小的环上有6个碳原子B.分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键C.
下列晶体按A1型方式进行紧密堆积的是( )。A.干冰 NaCl 金属铜B.ZnS 金属镁 氮化硼C
下列晶体按A1型方式进行紧密堆积的是()。A.干冰、NaCl、金属铜B.ZnS、金属镁、氮化硼C.水晶、金刚石、晶体硅D.ZnS、NaCl、金属镁
某物质熔融状态可导电 固态可导电 将其投入水中水溶液也可导电 则可推测该物质可能是 ( )A.
某物质熔融状态可导电,固态可导电,将其投入水中水溶液也可导电,则可推测该物质可能是()A.金属晶体B.分子晶体C.原子晶体D.离子晶体
下列说法正确的是( )A.分子晶体中一定存在分子间作用力 不一定存在共价键B.H2O比H2S稳定 是
下列说法正确的是()A.分子晶体中一定存在分子间作用力,不一定存在共价键B.H2O比H2S稳定,是因为H2O分子间能形成氢键而H2S不能C.晶体中含阳离子就一












