(12分)已知某工业废水中含有大量FeSO4 较多的Cu2+ 少量的Na+ 以及部分污泥 通过下列流
(12分)已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。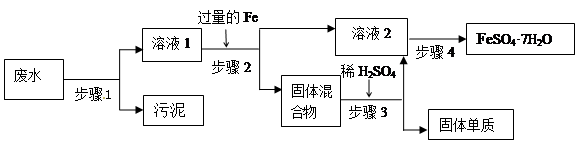 (1)步骤1、步骤2、步骤3的主要操作是 (填“相同”或“不相同”),需用到的玻璃仪器除烧杯外还有 。 (2)步骤2中发生反应的离子方程式为 (3)步骤3中发生反应的化学方程式为 (4)步骤4中涉及的操作是:蒸发浓缩. .过滤.洗涤.烘干。 (5)最后的固体单质是________(填名称) |
参考解答
| (1)相同(2分)、普通漏斗(填漏斗0分)(1分), 玻璃棒(1分)错填0分 (2)Fe2+ + Cu==Cu2+ + 2Fe(2分) (3)Fe+ H2SO4 ='=' FeSO4 + H2 ↑ (2分无气体符号扣1分) (4)冷却结晶(或填结晶给1分)(2分) (5)铜(2分填化学式0分) |
| (1)步骤1的目的是除去污泥的,步骤2的目的是除去铁和铜,步骤3的目的是除去铜,所以操作是相同的,都是过滤。过滤需用到的玻璃仪器除烧杯外还有普通漏斗、玻璃棒。 (2)铁的金属性强于铜,所以铁能置换出铜,方程式为Fe2+ + Cu==Cu2+ + 2Fe。 (3)过量的铁能和稀硫酸反应,但铜和稀硫酸不反应,所以方程式为Fe+ H2SO4 ='=' FeSO4 + H2 ↑。 (4)要从溶液中得到硫酸亚铁晶体,应该通过蒸发浓缩、冷却结晶来实现。 (5)铜和稀硫酸不反应,所以最后得到的是铜。 |
相似问题
提纯含有少量Ba(NO3)2杂质的KNO3溶液 可以使用的方法为( )A.加入过量的K2SO4溶液
提纯含有少量Ba(NO3)2杂质的KNO3溶液,可以使用的方法为( )A.加入过量的K2SO4溶液,过滤,向滤液中滴加适量的稀硝酸B.加入过量的Na2CO3溶液,过滤,
有关气体制备所用试剂及检验气体所用试剂不正确的组合是( )A.CO2;大理石和稀硫酸 ;澄清石
有关气体制备所用试剂及检验气体所用试剂不正确的组合是()A.CO2;大理石和稀硫酸,;澄清石灰石;B.Cl2;二氧化锰和浓盐酸,湿润的淀粉碘化钾试纸;C
下列物质分离方法错误的是( )A.用过滤的方法除去食盐水中的泥沙B.用四氯化碳萃取碘水中的碘
下列物质分离方法错误的是( )A.用过滤的方法除去食盐水中的泥沙B.用四氯化碳萃取碘水中的碘C.用蒸馏的方法将自来水制成蒸馏水D.用分液的方法分离硫酸和水
(14分)可用于分离或提纯物质的方法有:①过滤②蒸馏③加热④分液⑤结晶法⑥蒸发⑦萃取(填序号)(1)
(14分)可用于分离或提纯物质的方法有:①过滤②蒸馏③加热④分液⑤结晶法⑥蒸发⑦萃取(填序号)(1)除去石灰水中悬浮的CaCO3颗粒(2)除去NaCl晶体中
(每空1分 共5分).可用于分离或提纯物质的方法有:①过滤②蒸馏③加热④分液(填序号)(1)除去石灰
(每空1分,共5分).可用于分离或提纯物质的方法有:①过滤②蒸馏③加热④分液(填序号)(1)除去石灰水中悬浮的CaCO3颗粒(2)除去NaCl晶体中混有的碘












