某实验小组在进行双氧水分解的实验时发现:大家取相同体积 不同浓度的双氧水及不同质量的二氧化锰进行的实
| 某实验小组在进行双氧水分解的实验时发现:大家取相同体积、不同浓度的双氧水及不同质量的二氧化锰进行的实验,产生气体的速率都不相同,那么过氧化氢分解的最佳催化条件是什么呢?他们决定进行探究. (1)用下列简图,在方框中画出实验装置(含试剂)示意图. |
 |
| (2)小组经过实验,取得如下数据: |
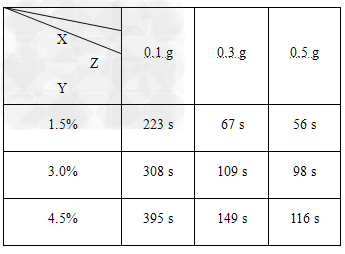 |
| (说明:表中X是二氧化锰的质量;Y是指反应停止时的时间;Z是双氧水的含量) 分析表中数据回答下列问题: ①相同浓度的双氧水的分解速率随着二氧化锰用量的增加而________. ②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择,理由是_____________________. ③该小组的小茂同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_________________. (提示:可比较相同体积的3.0%与1.5%的双氧水中所含溶质的倍数大小与二者反应结束所用时间的倍数大小作出比较) |
参考解答
(1)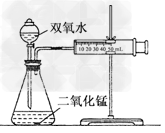 (2)①加快 ②0.3 ;用0.1 g催化剂的反应速率明显小于用0.3 g和0.5 g催化剂的反应速率,用0.5 g催化剂和用0.3 g催化剂的反应速率及反应时间相差不多,但用0.3 g催化剂节约药品 ③不正确 ;从表中数据可知,相同体积3.0%的双氧水中的溶质含量是1.5%的二倍,但反应的时间却比其反应时间的二倍小得多,由反应速率计算公式(v=Δc/Δt)可得出,此实验条件下双氧水的浓度越大分解速率越快 |
相似问题
某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液 设计如下实验。实验室提供的药
某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供的药品、仪器装置如下:药品:①2%NaOH溶液 ②稀HCl ③
学习卤代烃的性质时 王老师通过实验的方法验证溴乙烷在不同溶剂中与 NaOH反应生成不同的反应产物 请
学习卤代烃的性质时,王老师通过实验的方法验证溴乙烷在不同溶剂中与 NaOH反应生成不同的反应产物,请你一起参与他们的探究。 (1)王老师用上图所示装置
某实验小组以H2O2分解为例 研究浓度 催化剂 溶液酸碱性对反应速率的影响。在常温下按照如下方案完成
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。 (1)催化剂能加快化学反应速率的原因是____
已知难溶电解质在水溶液中存在溶解平衡: MmAn(s)mMn+(aq)+nAm-(aq)
已知难溶电解质在水溶液中存在溶解平衡: MmAn(s)mMn+(aq)+nAm-(aq) Ksp=cm(Mn+) ·cn(Am-),称为溶度积。某学习小组欲探究CaSO4沉淀转化为CaCO
用实验确定某酸HA是弱电解质。甲乙两个同学由于手上药品不同(玻璃仪器蒸馏水均有) 甲同学有pH试纸
用实验确定某酸HA是弱电解质。甲乙两个同学由于手上药品不同(玻璃仪器蒸馏水均有),甲同学有pH试纸,乙同学有锌粒,请补全两同学的方案(包括能证明HA












