某实验小组以H2O2分解为例 研究浓度 催化剂 溶液酸碱性对反应速率的影响。在常温下按照如下方案完成
| 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。 |
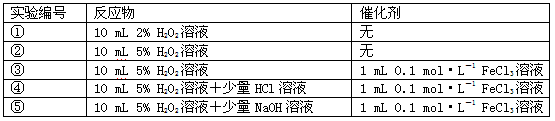 |
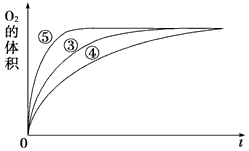
| (1)催化剂能加快化学反应速率的原因是__________________________________。 (2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为___________________。 (3)实验①和②的目的是___________________________________________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________________。 (4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。 分析上图能够得出的实验结论是_____________________________________________。 |
 |
参考解答
| (1)降低了反应所需的活化能 (2)H2O2 (3)探究浓度对反应速率的影响 ;向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中) (4)碱性环境能加快H2O2分解的速率,酸性环境能减慢H2O2分解的速率 |
相似问题
已知难溶电解质在水溶液中存在溶解平衡: MmAn(s)mMn+(aq)+nAm-(aq)
已知难溶电解质在水溶液中存在溶解平衡: MmAn(s)mMn+(aq)+nAm-(aq) Ksp=cm(Mn+) ·cn(Am-),称为溶度积。某学习小组欲探究CaSO4沉淀转化为CaCO
用实验确定某酸HA是弱电解质。甲乙两个同学由于手上药品不同(玻璃仪器蒸馏水均有) 甲同学有pH试纸
用实验确定某酸HA是弱电解质。甲乙两个同学由于手上药品不同(玻璃仪器蒸馏水均有),甲同学有pH试纸,乙同学有锌粒,请补全两同学的方案(包括能证明HA
在研究硝酸的性质时 某班学生做了如下三个实验:实验一:试管中加入铜片和浓硝酸 片刻后 立即塞上带有玻
在研究硝酸的性质时,某班学生做了如下三个实验:实验一:试管中加入铜片和浓硝酸,片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的
为证明某可溶性一元酸(HX)是弱酸 某同学设计了如下实验方案。其中不合理的是 [ ]A.室温
为证明某可溶性一元酸(HX)是弱酸,某同学设计了如下实验方案。其中不合理的是 [ ]A.室温下,测0 1 mol L HX溶液的pH,若pH>1,证明HX是弱酸 B.室
“碘钟”实验中 3I-+S2O82-=I3-+ 2SO42-的反应速率可以用I3-与加入的淀粉溶液显
“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进












