工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol/LNaOH溶液中得到漂白液。某同学想在
| 工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol/LNaOH溶液中得到漂白液。某同学想在实验室探究Cl2性质并模拟制备漂白液,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。 |
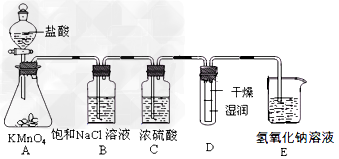 |
| ⑴配制450 mL物质的量浓度为0.375 mol/LNaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和__________。 ⑵浓硫酸的作用是____________________。 ⑶装置E中发生化学反应的离子方程式为____________________。 ⑷装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述饱和NaCl溶液除去Cl2中HCl气体的原理(用离子方程式表示和文字说明) ____________________。 ⑸实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因_______________;如需改进,请简述设计方案______________(若认为合理。则此问可不作答)。 ⑹氯元素含量为10%的漂白液355 g,其中含NaClO的物质的量为_________mol。 |
参考解答
| ⑴500 mL容量瓶 ⑵干燥氯气 ⑶Cl2 + 2OH-= Cl- + ClO-+ H2O ⑷HCl溶于水电离出的H+和饱和NaCl溶液中的Cl-都会对反应Cl2 + H2O  H+ + Cl-+ HClO 起到抑制作用 H+ + Cl-+ HClO 起到抑制作用⑸不合理,实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色;取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中(或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中) ⑹0.5 |
相似问题
为探究铁与浓硫酸在加热条件下的反应 某活动小组设计并完成以下实验:(1)实验目的:分析铁与浓硫酸在加
为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:(1)实验目的:分析铁与浓硫酸在加热条件下的反应。 ①洗气瓶中浓硫酸的作用是__
下列装置可用于某些气体的制备 干燥 性质的验证和尾气的处理(加热及夹持固定装置均略去) 请回答下列问
下列装置可用于某些气体的制备、干燥、性质的验证和尾气的处理(加热及夹持固定装置均略去),请回答下列问题(仪器装置可任意选用,必要时可重复选用)
某课外学习小组 为探究稀硝酸能与Cu反应生成无色的NO气体 设计了如下图所示的装置。请回答下列问题:
某课外学习小组,为探究稀硝酸能与Cu反应生成无色的NO气体,设计了如下图所示的装置。请回答下列问题:(1)请写出稀硝酸与Cu反应的离子方程式____________
I:某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质 设计如下图实验装置。请回答:(1)B
I:某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答:(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B
工业上制硫酸的设备分为三大部分 一是沸腾炉 二是接触室 三是吸收塔。在沸腾炉内煅烧黄铁矿生成二氧化硫
工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内煅烧黄铁矿生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与












