已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:溶质NaHCO3Na2CO3Na
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
|
参考解答
| C |
阳离子均为Na+和H+,Na2CO3溶液中Na+浓度是其他两种的两倍,阳离子浓度最大,NaCN溶液和NaHCO3溶泼中Na+浓度相等, NaCN溶液中H+浓度小于NaHCO3溶液,故阳离子浓度大小顺序为Na2CO3 > NaHCO3 >NaCN,A项错误;HCO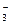 的水解能力小于CN-,故酸性:H2CO3>HCN,B项错误;升高Na2CO3溶液的温度,促进其水解, 的水解能力小于CN-,故酸性:H2CO3>HCN,B项错误;升高Na2CO3溶液的温度,促进其水解,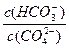 增大,D项错误。 增大,D项错误。 |
相似问题
在一定温度下 容器中加入CO和H2O(g)各1mol 发生反应:CO+H2OCO2+H2 达到平衡时
在一定温度下,容器中加入CO和H2O(g)各1mol,发生反应:CO+H2OCO2+H2,达到平衡时生成0 7mol的CO2,若其他条件和CO的起始量不变,一开始就加入4mol H2
在一定温度下 将1 mol N2和3 mol H2放入恒容密闭容器中 达到平衡时 测得NH3为0.8
在一定温度下,将1 mol N2和3 mol H2放入恒容密闭容器中,达到平衡时,测得NH3为0 8 mol,如果此时再加入1 mol N2和3 mol H2,达到新平衡时,NH
(8分)在一定体积的密闭容器中 进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g)
(8分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:t℃70080083010001200K0
已知N2+3H2=2NH3 △H<0 硫化氢难电离。下列事实不能用勒夏特列原理解释的是:A.给硫化氢
已知N2+3H2=2NH3 △H<0,硫化氢难电离。下列事实不能用勒夏特列原理解释的是:A.给硫化氢水溶液中加碱有利于S2-的生成B.加入催化剂有利于氨的氧化反
用CH4催化还原NOx可以消除氮氧化合物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+
用CH4催化还原NOx可以消除氮氧化合物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ mol②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);


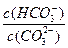 减小
减小









