在某温度下 向容积为2 L的恒容密闭容器中充入0.10 mol AB2和一定量的B2发生反应:2AB
在某温度下,向容积为2 L的恒容密闭容器中充入0.10 mol AB2和一定量的B2发生反应:2AB2(g)+B2(g) 2AB3(g),当容器中的气体压强不再变化时测得AB2的转化率为80%。已知该温度下上述反应的平衡常数K=2.0×102,则开始时加入B2的物质的量为 2AB3(g),当容器中的气体压强不再变化时测得AB2的转化率为80%。已知该温度下上述反应的平衡常数K=2.0×102,则开始时加入B2的物质的量为
|
参考解答
| A |
2AB2(g) + B2(g) 2AB3(g) 2AB3(g)起始浓度 0.05mol/L x 0 变化浓度 0.05×80%=0.04 0.02 0.04 平衡浓度 0.01 x—0.02 0.04 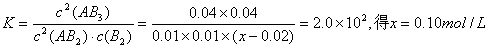 即 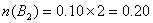 ;所以正确选项为A。 ;所以正确选项为A。 |
相似问题
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:溶质NaHCO3Na2CO3Na
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:溶质NaHCO3Na2CO3NaCNpH8 411 611 1下列说法中正确的是()A.阳离子的物质的量浓度之和:N
在一定温度下 容器中加入CO和H2O(g)各1mol 发生反应:CO+H2OCO2+H2 达到平衡时
在一定温度下,容器中加入CO和H2O(g)各1mol,发生反应:CO+H2OCO2+H2,达到平衡时生成0 7mol的CO2,若其他条件和CO的起始量不变,一开始就加入4mol H2
在一定温度下 将1 mol N2和3 mol H2放入恒容密闭容器中 达到平衡时 测得NH3为0.8
在一定温度下,将1 mol N2和3 mol H2放入恒容密闭容器中,达到平衡时,测得NH3为0 8 mol,如果此时再加入1 mol N2和3 mol H2,达到新平衡时,NH
(8分)在一定体积的密闭容器中 进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g)
(8分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:t℃70080083010001200K0
已知N2+3H2=2NH3 △H<0 硫化氢难电离。下列事实不能用勒夏特列原理解释的是:A.给硫化氢
已知N2+3H2=2NH3 △H<0,硫化氢难电离。下列事实不能用勒夏特列原理解释的是:A.给硫化氢水溶液中加碱有利于S2-的生成B.加入催化剂有利于氨的氧化反












