T ℃时 A气体与B气体反应生成C气体。反应过程中A B C浓度变化如图(Ⅰ)所示 若保持其他条件不
T ℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1℃和T2℃时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是: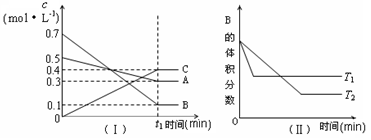  A.该平衡体系的化学反应方程式为:3A(g)+B(g) 4 C(g) A.该平衡体系的化学反应方程式为:3A(g)+B(g) 4 C(g)B.在t1时间内用B表示该反应的平均速率为0.6/ t1 mol·L-1·min-1 C.其他条件不变,升高温度,正反应速率减小、逆反应速率增大,A的转化率减小 D.维持温度和容器体积不变,往平衡体系中充惰性气体,C的百分含量增大 |
参考解答
| B |
正确答案:B 由图2升高温度,B体积分数增大,平衡逆向移动,正反应放热。 A、不正确,由图1三种物质A、B、C三种物质的变化量之比为:0.2:0.6:0.4=1:3:2,该平衡体系的化学反应方程式为:1A(g)+3B(g)  2C(g) 2C(g)B、正确; C、不正确,其他条件不变,升高温度,正反应速率增大、逆反应速率增大,平衡逆向移动,A的转化率减小 D、不正确,平衡不移动,总物质的量在增加,但C在整个体系中的百分含量减小。 |
相似问题
.下列叙述中 能用勒夏特列原理解释的是A.向反应体系中加入催化剂以加快化学反应速率B.温度越高 化学
下列叙述中,能用勒夏特列原理解释的是A.向反应体系中加入催化剂以加快化学反应速率B.温度越高,化学反应速率越快C.由H2(g)、I2(g)、HI(g)组成的平衡
能够充分说明在恒温恒容下的密闭容器中反应:2SO2+O22SO3 已经达到平衡的标志是A.容器中SO
能够充分说明在恒温恒容下的密闭容器中反应:2SO2+O22SO3,已经达到平衡的标志是A.容器中SO2、O2、SO3共存B.容器中SO2和SO3的浓度相同C.容器中SO2、O
在容积固定的容器中发生反应:CO(g)+2H2(g)CH3OH(g) △H
在容积固定的容器中发生反应:CO(g)+2H2(g)CH3OH(g)△H<0,各物质的浓度如下表下列说法不正确的是( )A.2min-4min内用氢气表示的速率为0 3mol (L?min)B
若平衡体系A+BC+D 增大压强时反应速率变化如下图所示。则下列关于各物质状态的说法正确的是A. A
若平衡体系A+BC+D,增大压强时反应速率变化如下图所示。则下列关于各物质状态的说法正确的是A. A、B、C、D都是气体B. C、D都是气体,A、B中有一种
对达到平衡状态的可逆反应X+YZ+W 在其他条件不变的情况下 增大压强 反应速率变化图象如右图所示
对达到平衡状态的可逆反应X+YZ+W,在其他条件不变的情况下,增大压强,反应速率变化图象如右图所示,则图象中关于X、Y、Z、W四种物质的聚集状态为A.Z












