(12分)某研究小组欲探究SO2的化学性质 设计了如下实验方案。(1)在B中检验SO2的氧化性 则
(12分)某研究小组欲探究SO2的化学性质,设计了如下实验方案。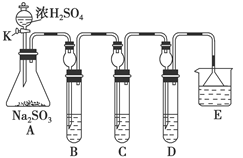 (1)在B中检验SO2的氧化性,则B中所盛试剂可为________。 (2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为__________________________。 (3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题: 限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。 (ⅰ)假设一:该白色沉淀为CaSO3; 假设二:该白色沉淀为________; 假设三:该白色沉淀为上述两种物质的混合物。 (ⅱ)基于假设一,填写下表:
__________________________________________________。 |
参考解答
| (1)硫化氢水溶液(或硫化钠、硫氢化钠溶液) (2) 2Fe3++SO2+2H2O═2 Fe2+SO42-+4H+; (3)(i)CaSO4;(ii)
|
试题分析:(1)硫化氢水溶液(或硫化钠、硫氢化钠溶液)中的硫元素都为-2价,与二氧化硫反应,化合价会升高,被氧化,二氧化硫表现氧化性,如:2H2S+SO2=3S+2H2O中, SO2表现氧化性;(2)FeCl3溶液与SO2反应生成硫酸亚铁和盐酸,反应的离子方程式为2Fe3++SO2+2H2O═2 Fe2+SO42-+4H+;(3)(i)新制漂白粉浓溶液中含有的次氯酸根离子具有强氧化性,二氧化硫具有还原性,可能会发生氧化还原反应,生成产物可能为CaSO4;故假设二:该白色沉淀为CaSO4;(ii)基于假设一:白色沉淀为CaSO3,亚硫酸钙和盐酸反应CaSO3+2HCl═CaCl2+SO2↑+H2O,二氧化硫能使品红溶液褪色,也能使澄清石灰水变浑浊,实验操作为用另一干净试管取少量沉淀样品,加入过量(或适量)0.5 mol?L-1HCl,将产生的气体通入品红溶液(或新制澄清石灰水); 若固体完全溶解,有气泡产生,且能使品红溶液褪色(或新制澄清石灰水变浑浊),则假设一成立;否则,假设一不成立;(iii)若假设二成立,漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能将二氧化硫氧化为硫酸根,生成该白色沉淀的化学方程式:Ca(ClO)2+H2O+SO2=CaSO4+2HCl。 |
相似问题
现有标准状况下的35.5g Cl2 回答下列问题:(1)其体积约为__________ L;(2)将
现有标准状况下的35 5g Cl2,回答下列问题:(1)其体积约为__________ L;(2)将其与H2完全化合生成HCl,此反应的化学方程式为:___________ ;(3
氯是富集在海水中的元素。下列有关氯气的说法不正确的是[ ]A.氯气是无色无味的气体 B.氯气
氯是富集在海水中的元素。下列有关氯气的说法不正确的是[ ]A.氯气是无色无味的气体 B.氯气有毒C.氯气可用于自来水的消毒 D.氯气是一种强氧化剂
下列实验现象 与新制氯水中的某些成分(括号内物质)没有关系的是 [ ]A.将NaHCO3固体
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是[ ]A.将NaHCO3固体加入新制氯水,有无色气泡(H+) B.使红色布条褪色(HCl) C.
兴趣小组探究SO2气体还原Fe3+ I2 他们使用的药品和装置如图所示:(1)SO2气体还原Fe3+
兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:(1)SO2气体还原Fe3+的产物是________(填离子符号),参加反应的SO2和Fe3+的物质的量
在体积为100mL浓度为18mol·L-1的浓硫酸中加入过量铜片并加热 问被还原的硫酸的物质的量为(
在体积为100mL浓度为18mol·L-1的浓硫酸中加入过量铜片并加热,问被还原的硫酸的物质的量为()A、等于0.9mol B、大于0.9mol C、小于0.9mol D无法确定












