用双线桥分析下列氧化还原反应 并指出氧化剂还原剂①Fe+2HCl=FeCl2+H2↑
| 用双线桥分析下列氧化还原反应,并指出氧化剂还原剂 ①Fe+2HCl=FeCl2+H2↑ 氧化剂______还原剂______ ②MnO2+4HCl
③2Na+2H2O=2NaOH+H2↑ 氧化剂______还原剂______. |
参考解答
①在反应Fe+2HCl=FeCl2+H2↑中,化合价降低元素是氢元素,所在的反应物HCl是氧化剂,化合价升高元素是铁元素,所在的反应物Fe是还原剂,化合价升高数=化合价降低数=转移电子数=2,故答案为: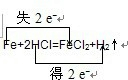 ;氯化氢;铁; ②氧化还原反应根据氧化剂和还原剂可以分为:完全氧化还原反应和部分氧化还原反应,这是一个部分氧化还原反应,这里的还原剂氯化氢部分(50%)被氧化,化合价降低元素是Mn元素,所在的反应物二氧化锰是氧化剂,化合价升高元素是Cl元素,所在的反应物HCl是还原剂,化合价升高数=化合价降低数=转移电子数=2,故答案为: 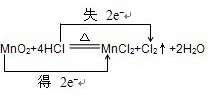 ;二氧化锰;氯化氢; ③在反应2Na+2H2O=2NaOH+H2↑中,化合价降低元素是氢元素,所在的反应物水是氧化剂,化合价升高元素是钠元素,所在的反应物钠是还原剂,化合价升高数=化合价降低数=转移电子数=2,故答案为: 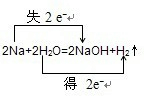 ;水;钠. |
相似问题
下列是某学生总结的一些规律 其中正确的是( )A.一种元素可能有多种氧化物 但是同种化合价只对应一
下列是某学生总结的一些规律,其中正确的是( )A.一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物B.酸性氧化物都可以与碱反应,生成盐
实验室中所用少量氯气是用下列方法制取的 4HCl(浓)+MnO2 △ . Cl2↑+MnCl2+
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2△ Cl2↑+MnCl2+2H2O试回答下列问题:(1)该反应是氧化还原反应吗?______,如果是氧化还原反
维生素C又称抗坏血酸 能够将I2转化为I- 说明维生素C的性质是( )A.易溶于水B.受热易分解C
维生素C又称抗坏血酸,能够将I2转化为I-,说明维生素C的性质是( )A.易溶于水B.受热易分解C.具有还原性D.可由人体自身合成
在 4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O的反应中 还原剂是______ 氧化剂
在4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O的反应中,还原剂是______,氧化剂是______,每生成lmolCl2转移______mol电子.
下列关于氧化还原反应的说法正确的是( )A.一定有氧气参加B.一定有电子转移C.一定属于置换反应D
下列关于氧化还原反应的说法正确的是( )A.一定有氧气参加B.一定有电子转移C.一定属于置换反应D.氧化反应先于还原反应












