氧化还原反应在生产 生活中具有广泛用途 贯穿古今。(1)下列生产 生活中的事例中有发生氧化还原反应的
| 氧化还原反应在生产、生活中具有广泛用途,贯穿古今。 (1)下列生产、生活中的事例中有发生氧化还原反应的是 。(有两个正确选项)
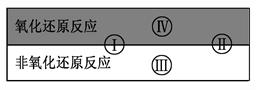 试写出有水参加的符合反应类型Ⅳ的一个化学方程式: 其中水为 剂。 (3)氯化铵常用于焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为: CuO+ NH4Cl = Cu+ CuCl2+ N2+ H2O ①配平此氧化还原反应方程式 ②该反应中,被氧化的元素是 (填元素名称),氧化剂是 (填化学式) ③反应中若产生0.2mol的气体,则有 个电子转移。 |
参考解答
| 13.(9分)(1) BD (1分,少选、错选不得分)(2) 2Na + H2O =' 2NaOH' + H2 ↑(2分); 氧化 (1分)(其他合理答案参照给分)(3)①4 2 3 1 1 4(2分,系数为1不标得一分)② 氮 (1分), CuO (1分)③1.2NA/7.2×1023(1分) |
试题分析:(1)凡是有元素化合价升降的反应都是氧化还原反应,所以选项BD中都涉及氧化还原反应,选项AC是物理变化,一定不是氧化还原反应,答案选BD。(2)Ⅳ是置换反应,因此符号条件的可以是C+H2O(g)  CO+H2,在该反应中氢元素的化合价降低,所以水是氧化剂。(3)①氧化铜具有氧化性,能氧化氯化铵。在反应中铜的化合价从+2价降低到0价,得到2个电子。氮元素的化合价从-3价升高到0价,失去3个电子,所以氧化剂和还原剂的物质的量之比是3︰2,因此反应的方程式为4CuO+2NH4Cl CO+H2,在该反应中氢元素的化合价降低,所以水是氧化剂。(3)①氧化铜具有氧化性,能氧化氯化铵。在反应中铜的化合价从+2价降低到0价,得到2个电子。氮元素的化合价从-3价升高到0价,失去3个电子,所以氧化剂和还原剂的物质的量之比是3︰2,因此反应的方程式为4CuO+2NH4Cl 3Cu+CuCl2+N2↑+4H2O。②氮元素的化合价升高,所以被氧化的元素是氮;铜元素的化合价降低,因此氧化铜是氧化剂。③根据方程式可知,每生成1mol氮气,转移6mol电子,所以若产生0.2 mol的气体,则有1.2mol气体生成。转移电子数为1.2NA/7.2×1023。 3Cu+CuCl2+N2↑+4H2O。②氮元素的化合价升高,所以被氧化的元素是氮;铜元素的化合价降低,因此氧化铜是氧化剂。③根据方程式可知,每生成1mol氮气,转移6mol电子,所以若产生0.2 mol的气体,则有1.2mol气体生成。转移电子数为1.2NA/7.2×1023。 |
相似问题
下列工业中 可能不涉及氧化还原反应的是A.海水淡化工业B.硫酸工业C.炼钢工业D.合成氨工业
下列工业中,可能不涉及氧化还原反应的是A.海水淡化工业B.硫酸工业C.炼钢工业D.合成氨工业
下列判断正确的是( )①维生素C具有还原性 在人体内起抗氧化作用②NO2溶于水时发生氧化还原反应③
下列判断正确的是()①维生素C具有还原性,在人体内起抗氧化作用②NO2溶于水时发生氧化还原反应③1 mol Cl2参加反应转移电子数一定为2NA④阴离子都只
(6分)2012年9月7日 云南省彝良地区连续发生5.7级地震 为了防止疫病流行 全国各地向灾区运送
(6分)2012年9月7日,云南省彝良地区连续发生5 7级地震,为了防止疫病流行,全国各地向灾区运送了大量的消毒剂、漂白剂等。过氧化物是很好的选择,下列
Ⅰ.在一体积为10 L的容器中 通入一定量的CO和H2O 在850℃时发生如下反应:CO(g)+H2
Ⅰ 在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示:(1)0~4 mi
ClO2是一种消毒杀菌效率高的消毒剂 有强氧化性。工业上ClO2常用NaClO3和Na2SO3溶液混
ClO2是一种消毒杀菌效率高的消毒剂,有强氧化性。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得。则有关此反应的说法正确的是()A.NaC












