某兴趣小组挤究SO2气体还原Fe3+ I2 他们使用的药品和装置如下图所示:(1)SO2气体还原Fe
某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: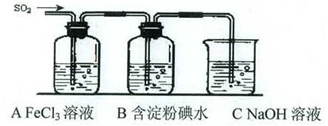 (1)SO2气体还原Fe3+反应的产物是_____________、_____________(填离子符号)。 (2)下列实验方案可以用于在实验室制取所需SO2的是____。
(4)如果有280 mL SO2气体(已折算为标态)进入C装置中,则C中50 mL NaOH溶液的浓度至少为_____________mol/L才能达到目的。 (5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验: 方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。 方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。 方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。 上述方案不合理的是____,原因是_______________________________________。 (6)能表明I-的还原性弱于SO2的现象是_________________________________________,写出有关离子方程式:_______________________________________。 |
参考解答
| (本题共12分)(1)Fe2+、SO42-;(2分) (2)BD(2分) (3)除去多余的SO2,防止污染空气(2分)。 (4)0.25mol/L(2分) (5)①;SO2、Fe2+都能使酸性高锰酸钾褪色(2分) (6)B中蓝色褪去;I2+SO2+2H2O→4H++2I- +SO42-(2分) |
试题分析:(1)铁离子具有氧化性,SO2具有还原性,二者发生氧化还原反应,反应的方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,所以SO2气体还原Fe3+反应的产物是Fe2+、SO42-。 (2)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错;B、浓硫酸虽具有强氧化性性,但不能氧化亚硫酸钠,故B正确;C、固体硫在纯氧中燃烧,操作以及氧气的用量不容易控制,故C错;D、Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O,故D正确答案选BD。 CuSO4+SO2↑+2H2O,故D正确答案选BD。(3)SO2是大气污染物,直接排放容易造成环境污染,所以需要尾气处理。由于二氧化硫是酸性氧化物能和碱反应生成盐和水,所以可用碱液处理二氧化硫,所以重装C的作用是除去多余的SO2,防止污染空气。 (4)SO2的物质的量是0.28L÷22.4L/mol=0.0125mol,和氢氧化钠溶液反应生成亚硫酸氢钠时消耗的氢氧化钠最少,所以至少需要氢氧化钠的物质的量是0.0125mol,其浓度是0.0125mol÷0.05L=0.25mol/L。 (5)因为SO2、Fe2+均具有还原性,二者都能使酸性高锰酸钾褪色,所以方案①是错误的。 (6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,有关反应的方程式是I2+SO2+2H2O→4H++2I- +SO42-。在反应中碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,所以能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色。2的制备、性质检验;氧化还原反应的有关判断以及实验方案设计和评价等 |
相似问题
在NaIO3的碱性溶液中通入氯气 可以得到Na2H3IO6。下列有关该反应的说法错误的是A.在该反应
在NaIO3的碱性溶液中通入氯气,可以得到Na2H3IO6。下列有关该反应的说法错误的是A.在该反应中NaIO3作还原剂B.碱性条件下,氯气氧化性强于Na2H3IO6C.反
Ⅰ.现有八种微粒:Na Mg2+ Fe2+ Fe3+ S2- SO2 HCl H2O 从元素化合价的
Ⅰ.现有八种微粒:Na、Mg2+、Fe2+、Fe3+、S2-、SO2、HCl、H2O,从元素化合价的角度分析,其中只有氧化性的是______,只有还原性的是______,既有氧化性
(10分)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为: K
(10分)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为: KClO3+ HCl(浓)= KCl + ClO2↑+ Cl2↑+(1)请完成该
下列应用不涉及氧化还原反应的是A.实验室用NH4Cl 和Ca(OH)2制备NH3B.工业上电解熔融状
下列应用不涉及氧化还原反应的是A.实验室用NH4Cl 和Ca(OH)2制备NH3B.工业上电解熔融状态Al2O3制备Al C.工业上利用合成氨实现人工固氮 D.Na2O2用作呼吸面具的供氧剂
(12分)⑴铁钉在氯气中被锈蚀为棕黄色物质FeCl3 而在盐酸中却生成浅绿色的FeCl2溶液。则在C
(12分)⑴铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中却生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是___________,其中氧化性最强












