Ⅰ.现有八种微粒:Na Mg2+ Fe2+ Fe3+ S2- SO2 HCl H2O 从元素化合价的
| Ⅰ.现有八种微粒:Na、Mg2+、Fe2+、Fe3+、S2-、SO2、HCl、H2O,从元素化合价的角度分析,其中只有氧化性的是______ ,只有还原性的是_____ _, 既有氧化性又有还原性的是__________ _。 Ⅱ.已知能用氯酸钾与浓盐酸反应制取氯气,其化学方程式如下: KClO3+6HCl=KCl+3Cl2↑+ 3H2O ⑴用单线桥在上述方程式中标出电子转移的方向和数目。 ⑵标况下生成3.36LCl2,转移电子的物质的量为 ,被氧化的盐酸与未被氧化的盐酸质量之比为 。氧化产物与还原产物物质的量之比为 。 |
参考解答
Fe3+,Mg2+(1分); Na, S2ˉ(1分); Fe2+,SO2,HCl,H2O(1分);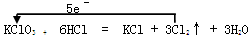 (线桥1分,电子数1分,共2分) (线桥1分,电子数1分,共2分)0.25mol(1分); 5:1(1分); 5:1(1分) |
试题分析::Ⅰ.Na, S2ˉ均为元素的最低价,则只具有还原性, Fe3+,Mg2+均为元素的最高价,则只具有氧化性, Fe2+,SO2,HCl,H2O处于中间价态元素的离子既有氧化性又有还原性。 Ⅱ.(1) 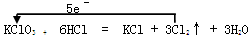 (2)标况下生成3.36LCl2,Cl2的物质的量为n='V/Vm' =3.36L/(22.4L/mol)=0.15mol,则反应的HCl的物质的量为0.3mol,转移电子的物质的量为5/6×0.3mol=0.25mol;化合价升高和化合价未变的物质量之比为5:1,所以被氧化的盐酸与未被氧化的盐酸质量之比为5:1。氧化产物与还原产物物质的量之比为5:1。 |
相似问题
(10分)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为: K
(10分)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为: KClO3+ HCl(浓)= KCl + ClO2↑+ Cl2↑+(1)请完成该
下列应用不涉及氧化还原反应的是A.实验室用NH4Cl 和Ca(OH)2制备NH3B.工业上电解熔融状
下列应用不涉及氧化还原反应的是A.实验室用NH4Cl 和Ca(OH)2制备NH3B.工业上电解熔融状态Al2O3制备Al C.工业上利用合成氨实现人工固氮 D.Na2O2用作呼吸面具的供氧剂
(12分)⑴铁钉在氯气中被锈蚀为棕黄色物质FeCl3 而在盐酸中却生成浅绿色的FeCl2溶液。则在C
(12分)⑴铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中却生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是___________,其中氧化性最强
阿伏加德罗常数约为6.02×1023mol-1 下列说法中正确的是A.22.4 L CH3CHO中含
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是A.22.4 L CH3CHO中含有的分子数约为6 02×1023B.56g铁与足量稀H2SO4充分反应,转移电子数
二氧化氯是国际公认的高效安全杀菌消毒剂 工业制备ClO2的反应原理常采用:2NaClO3 + 4HC
二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理常采用:2NaClO3 + 4HCl = 2ClO2↑+Cl2↑+2H2O+2NaCl,下列关于该反应的说法












