与一定浓度的反应 生成 当的物质的量之比为时 实际参加反应的与的物质的量之比为( )。A.1:6
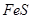 与一定浓度的 与一定浓度的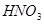 反应,生成 反应,生成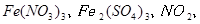 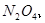 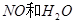 ,当 ,当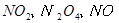 的物质的量之比为 的物质的量之比为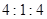 时,实际参加反应的 时,实际参加反应的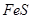 与 与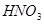 的物质的量之比为( )。 的物质的量之比为( )。
|
参考解答
| A |
试题分析: 令参加反应的FeS为1mol,则溶液中Fe2(SO4)3为1/3mol,Fe(NO3)3为1/3mol,反应中Fe元素、S元素化合价升高,N元素化合价降低,令NO2、N2O4、NO的物质的量分别为4amol、amol、4amol,根据电子转移守恒有:1×(3-2)+1×[6-(-2)=4a×(5-4)+a×(5-4)×2+4a×(5-2),解得a=0.5,故NO2、N2O4、NO的物质的量分别为2mol、0.5mol、2mol,故起氧化剂作用的HNO3为2mol+0.5mol×2+2mol=5mol,起酸的作用的硝酸生成Fe(NO3)3,故起酸的作用的硝酸为1/3mol×3=1mol,参加反应的硝酸为5mol+1mol=6mol,故实际参加反应的FeS与HNO3的物质的量之比为1mol:6mol=1:6,故选A。 |
相似问题
已知:Cl2+2I-=2Cl-+I2;Cl2+2Br-=2Cl-+Br2;Br2+2I-=2Br-+
已知:Cl2+2I-=2Cl-+I2;Cl2+2Br-=2Cl-+Br2;Br2+2I-=2Br-+I2。某溶液中Cl-、Br-、I-离子的物质的量之比为2:3:6。欲使溶液中三种离子比
在反应5NH4NO3 ='=' 2HNO3 + 4N2 + 9H2O中 发生氧化反应与发生还原反应的
在反应5NH4NO3 = "= " 2HNO3 + 4N2 + 9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是A.2:8B.5:3C.5:8D.5:4
实验室可通过以下反应来制取碘:2NO+O2=2NO2;2H++2I-+NO2=NO+I2+H2O在这
实验室可通过以下反应来制取碘:2NO+O2=2NO2;2H++2I-+NO2=NO+I2+H2O在这一过程中,每制取l mol I2时,所消耗氧化剂的质量是( )A.28gB.16gC.329D.46g
将NO3-+ Zn +OH-+H2O → NH3 +Zn(OH)42-配平后 离子方程式中OH-的化
将NO3-+ Zn +OH-+H2O → NH3 +Zn(OH)42-配平后,离子方程式中OH-的化学计量数是A.1B.3 C.5D.7
定量的CuS和Cu2S的混合物投入足量的HNO3中 收集到气体VL(标准状况) 向反应后的溶液中(存
定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,












