科研人员将软锰矿(MnO2含量≥65% SiO2含量约20% A12O3含量约4% 其余为水分)和闪
科研人员将软锰矿(MnO2含量≥65%,SiO2含量约20%,A12O3含量约4%,其余为水分)和闪锌矿(ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分)同槽酸浸开发出综合利用这两种资源的新工艺,如图所示为工艺流程的一部分.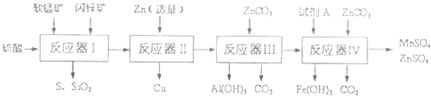 已知:ZnCO3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
(1)反应器I过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、A12(CO4)3等.试完成反应器I中生成CuSO4的化学方程式(不须配平):CuS+______+H2SO4→______+______+CuSO4+H2O (2)反应器II中发生反应的离子方程式为______. (3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)3沉淀的原因______.检验ZnCO3是否过量的操作方法是______. (4)反应器中IV中,试剂A可以是下列物质中______(填代号).a.氨水 b.氢氧化钠 c.MnO2 d.稀硫酸 (5)欲从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为______,要将分离出沉淀后的滤液进行浓缩,需将温度控制在90℃~100℃,可采用的加热方法是______. |
参考解答
| (1)反应I为酸浸过程,Mn、Al、Zn、Fe、Cu元素在该过程均转化为金属阳离子进入溶液,而难溶于酸的S、SiO2则通过过滤而分离出来, 故答案为:MnO2;S↓;MnSO4; (2)加入Zn后,Zn把Cu置换出来,而且Zn还原Fe3+,发生氧化还原反应.故答案为:Zn+2Fe3+=2Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+; (3)加入ZnCO3后,ZnCO3与溶液中的H+反应,导致溶液中c(H+)减小,c(OH-)增大,c(Al3+)?c(OH-)>Ksp[Al(OH)3,从而生成Al(OH)3沉淀;取少许沉淀于试管中,滴加适量的稀硫酸,若有气泡产生,则说明ZnCO3过量;若无气泡产生,则说明ZnCO3不过量.故答案为:ZnCO3与溶液中的H+反应,导致溶液中c(H+)减小,c(OH-)增大,从而生成Al(OH)3沉淀;取少许沉淀于试管中,滴加适量的稀硫酸,若有气泡产生,则说明ZnCO3过量;若无气泡产生,则说明ZnCO3不过量. (4)在所得虑液中加入MnO2将Fe2+氧化为Fe3+,再加入ZnCO3调节溶液pH 在5.2-5.4之间使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3而分离(超过5.4Zn(OH)2会析出).故选c; (5)从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为8.0≤pH<8.3(超过8.3Mn(OH)2会析出);将温度控制在90℃~100℃,最好采用水浴加热.故答案为:8.0≤pH<8.3;水浴加热. |
相似问题
在反应5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中 氧化剂是______
在反应5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,氧化剂是__________,还原剂是__________;氧化剂具有__________性;被氧化和被还原的原子数之比是__________。
FeS与一定浓度的HNO3反应 生成Fe(NO3)3 Fe2(SO4)3 NO2 N2O4 NO和H
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为4:1:4时,实际参加反应的FeS与HNO3的物质的量
将NO3-+ Zn +OH-+H2O → NH3 +Zn(OH)42-配平后 离子方程式中OH-的化
将NO3-+ Zn +OH-+H2O → NH3 +Zn(OH)42-配平后,离子方程式中OH-的化学计量数是[ ]A.1B.3 C.5 D.7
(14分)2013年6月 我国“蛟龙”号再次刷新“中国深度”——下潜7062米 为我国深海矿物资源的
(14分)2013年6月,我国“蛟龙”号再次刷新“中国深度”——下潜7062米,为我国深海矿物资源的开发奠定了基础。海洋深处有丰富的锰结核矿,锰结核的主要
工业上粗硅的生产原理为2C+SiO2Si+2CO↑ 下列说法正确的是A.SiO2是氧化剂B.SiO2
工业上粗硅的生产原理为2C+SiO2Si+2CO↑,下列说法正确的是A.SiO2是氧化剂B.SiO2发生氧化反应C.C表现出氧化性D.C被还原












