在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中(1)_____
| 在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中 (1)______是还原剂,______是还原产物. (2)该反应的离子方程式为:______. (3)用双线桥法分析此氧化还原反应 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O______ (4)NA表示阿伏伽德罗常数,若产生标准状况下的气体的体积为2.24L,则反应过程中转移电子的数目为______,被氧化的HCl的质量为______g. |
参考解答
| 在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素的化合价降低,Cl元素的化合价升高, (1)该反应中HCl为还原剂,KMnO4为氧化剂,则MnCl2为还原产物,故答案为:HCl;MnCl2; (2)在离子反应中,气体和水应保留化学式,该反应的离子反应为MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,故答案为:MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O; (3)该反应中Mn得到2×5e-,Cl失去10×e-,则双线桥法表示反应转移的电子的方向和数目为 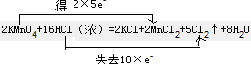 , 故答案为:  ; (4)若产生标准状况下的气体的体积为2.24L,n(Cl2)=
|
相似问题
KClO3 和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯 其变化可表述为:______ KC
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为:______KClO3+______HCl(浓)→______KCl+______ClO2+______Cl2↑+______
被称为万能还原剂的NaBH4 溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑下列说法正
被称为万能还原剂的NaBH4,溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑下列说法正确的是( )A.NaBH4既是氧化剂又是还原剂B.NaBH4是氧化剂,水是还原
高铁酸钾(K2FeO4)具有极高的氧化性 对环境无不良影响 被人们称为“绿色化学”试剂.某校化学兴趣
高铁酸钾(K2FeO4)具有极高的氧化性,对环境无不良影响,被人们称为“绿色化学”试剂.某校化学兴趣小组对高铁酸钾进行了如下探究.I、高铁酸钾制备:①
铜的冶炼过程大致可分为:①富集 将硫化物矿进行浮选; ②焙烧 主要反应为:2CuFeS2+4O2═C
铜的冶炼过程大致可分为:①富集,将硫化物矿进行浮选;②焙烧,主要反应为:2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣);③制粗铜,在1200℃发生的主要反应为
以辉铜矿(Cu2S)为原料冶炼铜 其反应原理可表示为:Cu2S+O2 高温 . 2Cu+SO2.下列
以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为:Cu2S+O2高温 2Cu+SO2.下列说法不正确的是( )A.化合价发生变化的元素有3种B.Cu2S在该反应中












