在下列物质转化关系中 反应的条件和部分产物已略去.回答下列问题:(1)若甲 乙是两种常见金属 反应Ⅲ
在下列物质转化关系中,反应的条件和部分产物已略去.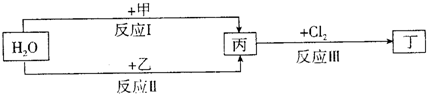 回答下列问题: (1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应. ①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是______. A.热分解法 B.热还原法 C.电解法 ②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是______. ③通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性______(填“强”或“弱”),比较二者金属性强弱的依据还可以是______(写出一种即可). (2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应. ①反应Ⅲ的化学方程式是______. ②反应I的另一种产物为有机物,则该有机物的电子式是______. ③反应Ⅱ是化合反应.乙可与硫酸铵共热反应制氨气,则此反应的化学方程式是______. ④在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体.其反应的离子方程式是______. |
参考解答
| (1)①反应Ⅲ是工业制盐酸的反应,根据元素守恒知,丙是氢气,丁是氯化氢;若甲、乙是两种常见金属,能和水反应的常见金属是铁、钠,焰色反应的物质含有钠元素,钠和水反应生成氢氧化钠和氢气,所以甲是钠乙是铁,钠是活泼金属,采用电解熔融盐的方法冶炼,故选C; ②通过以上分析知,乙是铁,高温条件下,铁和水反应生成四氧化三铁和氢气,反应方程式为2Fe+4H2O(g)
故答案为:2Fe+4H2O(g)
③根据反应条件知,钠的金属性比铁强,比较金属性强弱的方法还有:与酸反应置换氢气的难易程度、其碱的碱性强弱等, 故答案为:强;NaOH是强碱,Fe(OH)3是弱碱; (2)①若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应,则丙是氢氧化钙,氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水, 反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O; ②反应I的另一种产物为有机物,碳化钙和水反应生成乙炔和氢氧化钙,乙炔的电子式为: 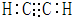 ,故答案为: 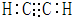 ; ③反应Ⅱ是化合反应.乙可与硫酸铵共热反应制氨气,则乙是氧化钙,氧化钙和硫酸铵反应生成硫酸钙、氨气和水,反应方程式为:CaO+(NH4)2SO4=CaSO4+2NH3↑+H2O, 故答案为:CaO+(NH4)2SO4=CaSO4+2NH3↑+H2O; ④氯水中含有盐酸和次氯酸,在饱和氯水中加块状石灰石,碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,从而能制得较浓HClO溶液, 离子反应方程式为:2Cl2+H2O+CaCO3=Ca2++2Cl-+2HClO+CO2↑,故答案为:2Cl2+H2O+CaCO3=Ca2++2Cl-+2HClO+CO2↑. |
相似问题
A B C是单质 x Y Z H J L是化合物 B在空气中燃烧也可得X和J x和J都是固体。在
A、B、C是单质,x、Y、Z、H、J、L是化合物,B在空气中燃烧也可得X和J,x和J都是固体。在适当的条件下,它们相互之间有下图所示的转化关系。 (1) 单质C
如图是部分元素的单质和化合物之间的相互转化关系 部分反应的生成物没有全部列出.已知原料A M均属于金
如图是部分元素的单质和化合物之间的相互转化关系,部分反应的生成物没有全部列出.已知原料A、M均属于金属氧化物,L是由两种沉淀组成的.F和Y反应能生成
A B C D分别代表硝酸银 偏铝酸钠 稀盐酸 浓氨水四种无色溶液中的一种.甲 乙两同学按不同体积比
A、B、C、D分别代表硝酸银、偏铝酸钠、稀盐酸、浓氨水四种无色溶液中的一种.甲、乙两同学按不同体积比进行了两两混合,实验现象如下:(1)根据图中A、C
A B是中学化学里常用的物质 其中B是单质 A是化合物;它们之间相互反应以及生成物之间的转化关系如下
A、B是中学化学里常用的物质,其中B是单质,A是化合物;它们之间相互反应以及生成物之间的转化关系如下图所示.已知,I、L两种物质中除了含有不同价态的B
物质X Y Z有如下转化关系请回答下列问题: (1)若X Y Z均为含铝元素的化合物 M的化学式可以
物质X、Y、Z有如下转化关系请回答下列问题: (1)若X、Y、Z均为含铝元素的化合物,M的化学式可以是_____________________。 (2)若M是第ⅣA族某元素的最












