某探究小组进行了以下实验:称取9.5g碳酸钠和碳酸氢钠混合物的粉末 向其中加入足量的稀硫酸 将生成的
| 某探究小组进行了以下实验:称取9.5g碳酸钠和碳酸氢钠混合物的粉末,向其中加入足量的稀硫酸,将生成的气体通入到足量的澄清石灰水中,充分反应后,过滤、洗涤、干燥,称量所得沉淀的质量为10.0g(假设过程中没有物质损耗)。求该混合物中碳酸钠的质量分数(写出计算过程,结果用分数表示)。 |
参考解答
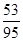 |
试题分析:设原混合物中碳酸钠和碳酸氢钠的物质的量分别是x与y,则根据总质量可知 106g/mol×x+84g/mol×y=9.5g ① 碳酸钠与碳酸氢钠和稀硫酸反应生成CO2气体,CO2与澄清的石灰水反应生成白色沉淀碳酸钙,即10.0g白色沉淀是碳酸钙,物质的量=10.0g÷100g/mol=0.1mol,则根据碳原子守恒可知生成的CO2的物质的量是0.1mol 根据反应的方程式可知 Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 1mol 1mol x x 2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑ 2mol 2mol y y 因此x+y=0.1mol ② 由①②联立解得x=y=0.05mol 所以原混合物中碳酸钠的质量分数= 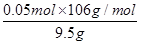 = =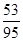 |
相似问题
现有NaHCO3和Na2CO3·xH2O的混合物 为了测定x值 某同学采用如图所示的装置进行实验(C
现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。(1)A装置的作用:__________________________
取16.8g碳酸氢钠固体 加热一段时间后 剩余固体的质量为13.7g。把剩余固体加入到100mL 2
取16 8g碳酸氢钠固体,加热一段时间后,剩余固体的质量为13 7g。把剩余固体加入到100mL 2mol L的稀硫酸中,充分反应后溶液中H+的浓度约为A.3 mol LB.
将过氧化钠和过量的碳酸氢钠在密闭容器中混合充分加热后 最终残留固体物质是A.Na2CO3
将过氧化钠和过量的碳酸氢钠在密闭容器中混合充分加热后,最终残留固体物质是A.Na2CO3 B.Na2O和Na2O2C.Na2O2
将70 g过氧化钠和氧化钠的混合物跟98 g水充分反应后 所得氢氧化钠溶液的质量分数为50%。(1)
将70 g过氧化钠和氧化钠的混合物跟98 g水充分反应后,所得氢氧化钠溶液的质量分数为50%。(1)求原混合物中过氧化钠和氧化钠的质量;(2)产生的气体标况下体积。
(16分)某小组的同学对放置已久的过氧化钠的成份进行探究 请回答下列问题:(1)反应 2Na2O2+
(16分)某小组的同学对放置已久的过氧化钠的成份进行探究,请回答下列问题:(1)反应 2Na2O2+2H2O=4NaOH+O2↑的还原剂是(写化学式);反应2Na2O2












