某兴趣小组为测定某工业纯碱(假设仅含NaHCO3杂质)中Na2CO3的质量分数 设计了下列四种实验方
| 某兴趣小组为测定某工业纯碱(假设仅含NaHCO3杂质)中Na2CO3的质量分数,设计了下列四种实验方案: 方案一:纯碱样品  测定剩余固体质量 测定剩余固体质量(1)称取mg样品放入坩埚中充分加热。坩埚中发生反应的化学方程式为: (2)将坩埚置于干燥器中冷却后称量。实验时需要重复“加热、冷却、称量”操作多次,其目的是: 。 方案二:称取mg样品配成250mL溶液,从中取25mL溶液先用酚酞作指示剂用0.1mol/LHCl溶液滴定至终点,消耗0.1mol/LHCl溶液V1mL,继续用甲基橙作指示剂滴定至终点,消耗0.1mol/LHCl溶液V2mL。则该样品中碳酸钠的质量分数为: 。 方案三:纯碱样品溶液  测定沉淀质量 测定沉淀质量(1)称取m1g样品,置于小烧杯中,加水溶解后滴加足量氯化钙溶液。将反应混和物过滤后的下一步操作是: ,沉淀经干燥后称量为m2g。 (2)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,_______测定样品中的Na2CO3的质量分数。(填“能”或“不能”) 方案四:纯碱样品  测定生成二氧化碳的质量 测定生成二氧化碳的质量(1)本实验采用如图装置,C中盛放的物质是 。 (2)反应前后都要通入N2,反应后通入N2的目的是: 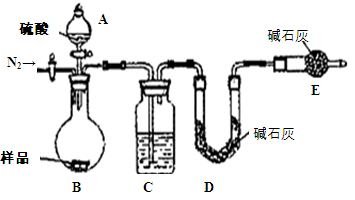 |
参考解答
| 方案一:(1)2NaHCO3=Na2CO3+CO2↑+H2O (2)加热至恒重,以保证NaHCO3全部分解 方案二: 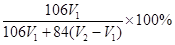 或 或 (3分) (3分)方案三:(1)洗涤沉淀 (2)能 方案四:(1)浓硫酸 (2)将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收 |
试题分析:方案一:该方案原理为:在加热条件下Na2CO3能够稳定存在,而NaHCO3易发生分解反应,从而根据残留的固体的量推算出样品中碳酸钠的质量分数;(1)坩埚中发生反应的化学方程式为:2NaHCO3 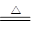 Na2CO3 + CO2↑+ H2O;(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解; Na2CO3 + CO2↑+ H2O;(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解;方案二:该实验方案的原理为用双指示剂法测定Na2CO3和NaHCO3的混合物中Na2CO3的质量分数,以酚酞作指示剂,发生的反应为Na2CO3+HCl=NaHCO3+NaCl,再以甲基橙作指示剂,发生的反应为NaHCO3+HCl=NaCl+H2O+CO2↑,根据上述原理,以酚酞作指示剂,发生的反应为Na2CO3+HCl=NaHCO3+NaCl,n(Na2CO3)='n(HCl)=' 10×0.1mol/L×0.001V1L='0.001' V1 mol,m(Na2CO3)='0.106' V1g,碳酸钠的质量分数为0.106 V1g/mg×100%='10.6' V1/m%; 方案三:该实验方案的原理为:纯碱样品中的碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和水,通过测定碳酸钙的质量来确定碳酸钠的质量分数;(1)碳酸钙沉淀会附着氯化钠、氯化钙等杂质,过滤后需用蒸馏水洗涤沉淀;(2)在一定量样品中加入足量Ca(OH)2溶液分别发生如下反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH, NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均产生CaCO3沉淀,根据样品的总质量和生成CaCO3沉淀的量,可以计算碳酸钠质量,能测得碳酸钠的质量分数; 方案四:该实验方案的原理为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑, 2NaHCO3+ H2SO4= Na2SO4+H2O+CO2↑,通过准确测定样品的质量和二氧化碳的质量,来计算碳酸钠的质量分数;(1)该反应产生的二氧化碳中含有水蒸气,会影响二氧化碳质量的测定,必须除去,故C装置的作用为干燥二氧化碳,盛放的物质是浓硫酸;(2)该方案关键是要准确测量产生的CO2的质量,实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被D中碱石灰完全吸收,导致测定结果有较大误差,所以反应前后都要通入N2,反应后通入N2的目的是:将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收。 |
相似问题
下列含有非极性键的共价化合物是A.HCl B.Na2O2 C.H2O2 D.H2
下列含有非极性键的共价化合物是A.HCl B.Na2O2 C.H2O2 D.H2
用金属钠制取Na2O通常采用下法:2NaNO2+6Na=4Na2O+N2↑根据要求回答问题:(1)不
用金属钠制取Na2O通常采用下法:2NaNO2+6Na=4Na2O+N2↑根据要求回答问题:(1)不采用Na在氧气中燃烧获得Na2O的原因是 。(2)上述方
区分碳酸钠和碳酸氢钠固体的方法中(相同条件下) 错误的是 A.加热 观察是否有气体放出B
区分碳酸钠和碳酸氢钠固体的方法中(相同条件下),错误的是A.加热,观察是否有气体放出B.滴加稀盐酸,比较产生气体的快慢C.溶于水后加氧化钙,看有无
过氧化钠是一种淡黄色固体 它能与二氧化碳反应生成氧气 在潜水艇中用作制氧剂 供人类呼吸之用.它与二氧
过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用 它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2 ="="
将标准状况下2.24LCO2缓慢通入100mL1.5mol·L-1NaOH溶液中(溶液体积变化忽略不
将标准状况下2 24LCO2缓慢通入100mL1 5mol·L-1NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列关系正确的是( )A.c()>c()B.c()+c()="1












