过氧化钠是一种淡黄色固体 它能与二氧化碳反应生成氧气 在潜水艇中用作制氧剂 供人类呼吸之用.它与二氧
过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2 。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出如下实验装置: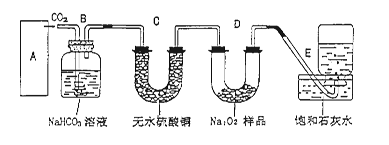 (1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图: 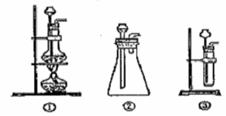 B装置的作用是 ,C装置内可能出现的现象是 。为了检验E中收集到的气体,在取出集气瓶后, 用 的木条伸入集气瓶内,木条会出现 。 (2)若E中的石灰水出现出现轻微白色浑浊,请说明原因: 。 (3)若D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象? (4)你认为上述A-E的实验装置中,E部分是否安全、合理?E是否需要改为下列四项中的哪一项: 。(用甲、乙、丙、丁回答) 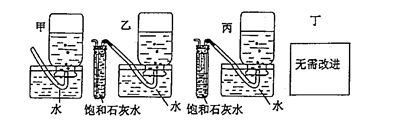 |
参考解答
| (1)图2 吸收A装置中产生的酸雾 变蓝 带火的木条 复燃 (2) D中有部分CO2未参加反应流入E中生成沉淀 (3)E中石灰水的白色浑浊明显增加,瓶内液面的下降接近停止 (4) 乙 |
试题分析:(1)实验室中制取CO2的原理是CaCO3+2HCl=CaCl2+H2O+CO2↑,由于该反应不需要加热,且浓盐酸具有挥发性,选择分液漏斗,所以装置是图②。生成的CO2中混有挥发出的氯化氢气体,所以B装置的作用是除去CO2中混有的氯化氢气体。另外生成的CO2中还混有水蒸气,所以通过C装置后,无水硫酸铜生成胆矾,而呈蓝色。过氧化钠和CO2反应生成氧气,氧气是助燃的。因此检验的方法是用带火星的木条伸入集气瓶内,木条会出现复燃现象。 (2)若E中的石灰水出现出现轻微白色浑浊,显然白色混浊是碳酸钙。这说明D中有部分CO2未参加反应流入E中生成沉淀碳酸钙造成的。 (3)过氧化钠样品接近反应完毕时,将不再生成氧气,所以瓶内液面的下降接近停止。另外由于CO2不再被吸收,所以E中石灰水的白色浑浊明显增加。 (4)由于生成的氧气中可能含有CO2,而CO2极易被石灰水吸收,从而干扰氧气的收集,所以需要改进,选择的装置就是乙,即在收集之前首先除去CO2。2的制备、除杂、过氧化钠的性质、氧气的收集、检验等 点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以本部分内容主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用的能力。 |
相似问题
将标准状况下2.24LCO2缓慢通入100mL1.5mol·L-1NaOH溶液中(溶液体积变化忽略不
将标准状况下2 24LCO2缓慢通入100mL1 5mol·L-1NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列关系正确的是( )A.c()>c()B.c()+c()="1
少量的金属钠长期暴露在空气中 它的最终产物是 A.NaOHB.Na2CO3·10H2OC.Na2CO
少量的金属钠长期暴露在空气中,它的最终产物是 A.NaOHB.Na2CO3·10H2OC.Na2CO3D.NaHCO3
150℃取mg某物质在氧气中完全燃烧 将其产物通过足量的过氧化钠固体 完全反应后固体的质量也增加了m
150℃取mg某物质在氧气中完全燃烧,将其产物通过足量的过氧化钠固体,完全反应后固体的质量也增加了mg。下列物质不能满足上述结果的是A.COB.H2C.C2H5OHD.C6H12O6
(5分)Na2CO3 NaHCO3 NaCl的固体混合物共4.0 g 把它们加强热到质量不再减轻 冷
(5分)Na2CO3、NaHCO3、NaCl的固体混合物共4 0 g,把它们加强热到质量不再减轻,冷却后称重为3 38 g。在残余固体中加入过量的盐酸,产生CO20 88 g。
已知:2CO(g)+O2(g)=2CO2(g) ΔH= -566 kJ?mol-1Na2O2(s)
已知:2CO(g)+O2(g)=2CO2(g) ΔH= -566 kJ?mol-1Na2O2(s)+CO2(g) = Na2CO3(s)+1 2O2(g) ΔH= -226 kJ?mol-1下列表述正确的是(NA代表阿伏伽德












