下表为元素周期表的一部分 表中列出了11种元素在周期表中的位置 按要求完成下列各小题。 主族周
下表为元素周期表的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。
(1)化学性质最不活泼的元素是 (填元素符号),其原子结构示意图为 。 (2)元素⑧的名称为 ,其最高价氧化物的水化物的化学式为 。 (3)元素③与元素⑧形成化合物的电子式为 。 (4)非金属性最强的元素是 (填元素符号)。除0族外原子半径最大的元素是 (填元素符号)。元素①单质与水反应的离子方程式是 。 (5)①、③、⑤三种元素的最高价氧化物水化物中,碱性最强的化合物的化学式是 。 (6)能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与①的最高价氧化物的水化物反应的化学方程式 。 |
参考解答
(1)Ar;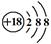 (2)氯 HClO4 (3) (2)氯 HClO4 (3)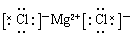 (4)F K 2Na+2H2O=2Na++2OH-+H2↑ (5)NaOH (6)Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
试题分析:根据元素在元素周期表中的位置可知,①为Na,②为K,③为Mg,④为Ca,⑤为Al,⑥为C,⑦为O,⑧为Cl,⑨为F,⑩为Ar,则 (1)上述元素中只有Ar最外层电子数为8,为稳定结构,则化学性质最不活泼的元素Ar,Ar的原子序数是18,位于第三周期0族,其原子结构示意图为  。 。(2)元素⑧的名称为氯,最高价是+7价,因此其最高价氧化物的水化物的化学式为HClO4。 (3)元素③与元素⑧形成化合物是氯化镁,含有离子键的离子化合物,其电子式为 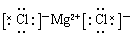 。 。(4)同周期自左向右金属性逐渐减弱,非金属性逐渐增强。同主族自上而下金属性逐渐增强,非金属性逐渐减弱,所以上述元素中只有F的非金属性最强,只有K的金属性最强,与水反应剧烈,该反应的化学方程式为2K+2H2O=2KOH+H2↑。 (5)同周期自左向右金属性逐渐减弱,非金属性逐渐增强,金属性越强最高价氧化物对应水化物的碱性越强,则①、③、⑤三种元素的最高价氧化物水化物中,碱性最强的化合物的化学式是NaOH。 (6)氢氧化铝是两性氢氧化物,所以最高价氧化物是两性氧化物的元素是Al,能和强碱反应生成盐和水,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。 |
相似问题
元素R X T Z Q在元素周期表中的相对位置如下表所示 其中R单质在暗处与H2剧烈化合并发生爆炸。
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是RXTZQA.非金属性:Z<T<XB.R与Q的
元素的原子结构决定其性质和在周期表中的位置 下列说法中正确的是A.元素周期表中位于金属和非金属分界线
元素的原子结构决定其性质和在周期表中的位置,下列说法中正确的是A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素B.某微粒的结构示意简图
X Y Z W是短周期的四种元素 有关他们的信息如表所示。元素部分结构知识部分性质XX的单质由双原子
X、Y、Z、W是短周期的四种元素,有关他们的信息如表所示。元素部分结构知识部分性质XX的单质由双原子分子构成,分子中有14个电子X有多种氧化物,如XO、XO
下列有关原子结构及元素周期律的叙述正确的是A.同主族元素的原子最外层电子数相同 化学性质也相同B.同
下列有关原子结构及元素周期律的叙述正确的是A.同主族元素的原子最外层电子数相同,化学性质也相同B.同周期元素(除0族元素外)从左到右,原子半径逐渐减
L—T 5种短周期元素的信息如下表 有关叙述正确的是( )元素代号LMQRT原子半径/nm0.1
L—T 5种短周期元素的信息如下表,有关叙述正确的是()元素代号LMQRT原子半径/nm0 1600 1430 1120 1040 066主要化合价+2+3+2+6、+4、-2-2A.与稀盐酸












