短周期元素X Y Z W在元素周期表中的相对位置如右图所示 其中Z的核电荷数是Y的2倍。下列判断不正
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中Z的核电荷数是Y的2倍。下列判断不正确的是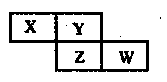
|
参考解答
| D |
| 试题分析:短周期元素中Z的核电荷数是Y的2倍,而且二者是同一主族的元素,则二者的原子序数相差8,则Y为O;Z为S;X为N;。W为Cl。A.同一主族的元素,从上到下,元素的非金属性逐渐减弱。元素的非金属性越弱,其氢化物的稳定性就越差。非金属性O>S。所以最简单气态氢化物的热稳定性:H2O>H2S。正确。B.HNO3、HClO4都是强酸,但是HClO4是已知酸中最强的一种酸。所以酸性最高价氧化物的水化物的酸性:HNO3<HClO4。正确。C.NH3与HNO3可形成盐NH4NO3。该盐是离子化合物。正确。D. H2O、H2S都是由分子构成的物质。分子间作用力越大,物质的熔点、沸点就越高。结构相似的物质,相对分子质量越大,。熔点、沸点就越高。沸点H2O>H2S,是因为在水的分子之间除了存在分子间作用力外,还存在氢键,增加了分子之间的相互作用。使物质融化或汽化需要消耗的能量就越高。即物质的熔点、沸点就越高。这与分子内的化学键无关。错误。 |
相似问题
有4组同一族元素所形成的不同物质 在101kPa时测定它们的沸点(℃)如表所示 则下列各项判断正确的
有4组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如表所示,则下列各项判断正确的是()第一组He -268 8(a) -249 5Ar -18
下列能说明氯元素比硫元素非金属性强的是①HCl比H2S稳定;②HClO4酸性比H2SO4强;③Cl2
下列能说明氯元素比硫元素非金属性强的是①HCl比H2S稳定;②HClO4酸性比H2SO4强;③Cl2能与H2S反应生成S;④Cl原子最外层有7个电子,S原子最外层有6个电子;
下图是元素周期表的一部分 针对表中的①~⑩中元素 填写下列空格:(1)在这10种元素中 非金属性最强
下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:(1)在这10种元素中,非金属性最强的是(填序号);(2)元素②⑧⑨以原子个数比1:1
【物质结构与性质】已知A B C D E都是元素周期表中前36号的元素 它们的原子序数依次增大。A原
【物质结构与性质】已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基
下列各组物质的性质比较 正确的是A.酸性:HClO4>H3PO4>H2SO4B.氢化物稳定性:H2S
下列各组物质的性质比较,正确的是A.酸性:HClO4>H3PO4>H2SO4B.氢化物稳定性:H2S>HF>H2OC.碱性:Al(OH)3>Mg(OH)2>NaOHD.氧化性:F2 > Cl2 > Br2 > I2












