【物质结构与性质】已知A B C D E都是元素周期表中前36号的元素 它们的原子序数依次增大。A原
| 【物质结构与性质】 已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。 (1)基态E原子的价电子排布式为 ; (2)AB32-的立体构型是 ,其中A原子的杂化轨道类型是 。 (3)A22-与B22+互为等电子体,B22+的电子式可表示为 ,1mol B22+中含有的π键数目为 。 (4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键 。 (5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为a g/cm3,则晶胞的体积是 (只要求列算式,阿伏加德罗常数的值为NA) 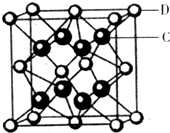 |
参考解答
| (1)3d54s1 (2)平面三角形 sp2 (3) 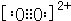 2NA 2NA(4)F-H…F、F-H…O、O-H…F、O-H…O (5)312/aNA cm3 |
| A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,则A原子有2个电子层,最外层电子数为4,故A为碳元素;C在元素周期表的各元素中电负性最大,则C为氟元素;B原子基态时s电子数与P电子数相等,原子序数小于氟元素,处于第二周期,核外电子排布为1s22s22p4,则B为氧元素;D的基态原子核外有6个能级且全部充满电子,核外电子排布为1s22s22p63s23p64s2,则D为Ca元素; E原子基态时未成对电子数是同周期元素中最多的,其原子外围电子排布为3d54s1,则E为Cr元素。 (1)E为Cr元素,基态原子的价电子排布式为3d54s1 (2)CO32-中C原子的价层电子对数为3+(4+2?2×3)/2=3,C原子孤对电子对数=(4+2?2×3)/2=0,CO32-为平面三角形,C原子采取sp2杂化 (3)C22-与O22+互为等电子体,离子结构相同,O22+的电子式可表示为 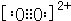 ,1mol O22+中含有的π键数目为2NA ,1mol O22+中含有的π键数目为2NA(4)HF水溶液中存在的所有氢键为:F-H…F、F-H…O、O-H…F、O-H…O (5)由化合物CaF2的晶胞结构可知,晶胞中含有钙离子数目为8×1/8++6×1/2=4 含有氟离子数目为8,故晶胞的质量为4×78g,该离子化合协晶体的密度为a g/cm3,则晶胞的体积=4×78/NA/ a g/cm3='312' /aNA cm3 |
相似问题
下列各组物质的性质比较 正确的是A.酸性:HClO4>H3PO4>H2SO4B.氢化物稳定性:H2S
下列各组物质的性质比较,正确的是A.酸性:HClO4>H3PO4>H2SO4B.氢化物稳定性:H2S>HF>H2OC.碱性:Al(OH)3>Mg(OH)2>NaOHD.氧化性:F2 > Cl2 > Br2 > I2
X Y Z Q W均为短周期元素 原子序数逐渐增大。X Q同主族 Q元素的焰色反应为黄 色;W的原子
X、Y、Z、Q、W均为短周期元素,原子序数逐渐增大。X、Q同主族,Q元素的焰色反应为黄色;W的原子半径是同周期中最小的;X与Y、Z分别形成化合物甲、乙,甲
已知a元素的阳离子 b元素的阴离子 c元素的阴离子具有相同的电子层结构 且b的阴离子半径大于c的阴离
已知a元素的阳离子,b元素的阴离子、c元素的阴离子具有相同的电子层结构,且b的阴离子半径大于c的阴离子半径,则其原子序数大小顺序为( ) A.c>b>aB.a
下表为元素周期表的一部分 请回答有关问题: ⅠAⅡAⅢAⅣAⅤAⅥAⅦA02 ①②③ 3④⑤⑥
下表为元素周期表的一部分,请回答有关问题:ⅠAⅡAⅢAⅣAⅤAⅥAⅦA02①②③3④⑤⑥⑦⑧⑨⑩(1)表中最活泼的金属是,非金属性最强的元素是(填写元素符
简单原子的原子结构可用下图的表示方法来形象表示 其中 表示质子或电子 表示中子。则下列有关①②
简单原子的原子结构可用下图的表示方法来形象表示,其中表示质子或电子,表示中子。则下列有关①②③的叙述中正确的是A.①、②、③互为同位素B.①、②












