(12分)(2012?山东)[化学﹣物质结构与性质]金属镍在电池 合金 催化剂等方面应用广泛.(1)
| (12分)(2012?山东)[化学﹣物质结构与性质]金属镍在电池、合金、催化剂等方面应用广泛. (1)下列关于金属及金属键的说法正确的是 . a.金属键具有方向性与饱和性 b.金属键是金属阳离子与自由电子间的相互作用 c.金属导电是因为在外加电场作用下产生自由电子 d.金属具有光泽是因为金属阳离子吸收并放出可见光 (2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 . (3)过滤金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= .CO与N2结构相似,CO分子内σ键与π键个数之比为 . (4)甲醛(H2C═O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为 ,甲醇分子内的O﹣C﹣H键角 (填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角. |
参考解答
| (1)b(2)c(3)4;1:2(4)sp3;小于 |
| (1)金属键没有方向性和饱和性,金属键是金属阳离子和自由电子间的相互作用,金属导电是因为自由电子在外加电场作用下发生定向移动,属具有光泽是因为自由电子能够吸收可见光; (2)Ni的外围电子排布为3d84s2,3d能级上有2个未成对电子; (3)CO配位时,提供碳原子上的一对孤对电子;CO中C和O以三键结合; (4)ABm型杂化类型的判断: 中心原子电子对计算公式:电子对数n=  (中心原子的价电子数+配位原子的成键电子数±电荷数) (中心原子的价电子数+配位原子的成键电子数±电荷数)注意:①当上述公式中电荷数为正值时取“﹣”,电荷数为负值时取“+”. ②当配位原子为氧原子或硫原子时,成键电子数为零. 根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;sp3杂化是四面体构型,sp2杂化,分子呈平面三角形. 解:(1)a.金属键没有方向性和饱和性,故A错误; b.金属键是金属阳离子和自由电子间的相互作用,故B正确; c.金属导电是因为自由电子在外加电场作用下发生定向移动,故C错误; d.金属具有光泽是因为自由电子能够吸收可见光,故D错误, 故答案为:b; (2)Ni的外围电子排布为3d84s2,3d能级上有2个未成对电子.第二周期中未成对电子数为2的元素有C、O,其中C的电负性小,故答案为:c; (3)中心原子价电子数与配体提供电子总数之和为18,中心原子是Ni,价电子排布3d84s2,共10个电子,CO配位时,提供碳原子上的一对孤对电子, 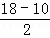 =4;CO中C和O以三键结合,含有1个σ键、2个π键,故答案为:4;1:2; =4;CO中C和O以三键结合,含有1个σ键、2个π键,故答案为:4;1:2;(4)甲醇分子内C的成键电子对数为4,无孤电子对,杂化类型为sp3,是四面体结构,甲醛分子中的碳采取sp2杂化,是平面三角形结构,甲醇分子内O﹣C﹣H键角比甲醛分子内O﹣C﹣H键角小,故答案为:sp3;小于. 点评:本题考查金属键与金属的物理性质的关系、原子轨道杂化方式及杂化类型判断、键能、键长、键角及其应用等,难度不大,(3)是易错点. |
相似问题
短周期元素A B C D原子序数依次增大 且A是短周期元素中原子半径最小的元素。A C位于同一主族
短周期元素A、B、C、D原子序数依次增大,且A是短周期元素中原子半径最小的元素。A、C位于同一主族,B的最外层电子数次外层的3倍,B、C的最外层电子数之和
W X Y Z是四种常见的短周期元素 其原子半径随原子序数变化如图。已知W的一种核素的质量数为18
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正
短周期元素R T Q W Z在元素周期表中的相对位置如下图所示 五种元素中只有一种金属元素。下列判断
短周期元素R、T、Q、W、Z在元素周期表中的相对位置如下图所示,五种元素中只有一种金属元素。下列判断错误的是( )RTQWZA.W的单质易溶于CS2B.Q与R可能
(8分)下列物质中互为同分异构体的有 互为同素异形体的有 属于同位素
(8分)下列物质中互为同分异构体的有,互为同素异形体的有,属于同位素的有,属于同一种物质的有。(填序号)①液氯 ②③白磷 ④18O ⑤⑥红磷⑦16O⑧氯气
已知X Y Z都是短周期元素 它们的原子序数依次增大 X原子的电子层数与它的核外电子总数相等 而Z原
已知X、Y、Z都是短周期元素,它们的原子序数依次增大,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种












