(13分)近现代战争中 制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢 热处理后整个装甲结
| (13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3 (1)铬元素的基态原子的价电子层排布式是 。 (2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 . (3)Mn和Fe的部分电离能数据如表:
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。 (4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。 某镍配合物结构如右图所示,分子内含有的作用力 有 (填序号)。 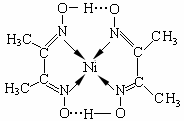 A.氢键 B.离子键 C.共价键 D.金属键 E.配位键 组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。 (5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是 (6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,则该磁性材料的化学式为 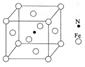 | ||||||||||||||
参考解答
| (1)3d54S1 (2) sp3 (3)Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态。) (4) ACE; N>O>C; (5) 分子晶体 (6)Fe4N |
试题分析:(1)原子处于全充满、半充满或全空时是稳定的状态。24号铬元素的基态原子的价电子排布式是3d54S1。(2)C元素Si元素组成的SiC晶体是原子晶体。其中的C原子的杂化方式为sp3。(3)根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态)。(4)在某镍配合物中含有共价键、配位键、氢键。选项为ACE。组成该配合物分子且同属第二周期元素有C、N、O。一般情况下,元素的非金属性越强,原子半径越小,元素的电负性就越大。但是对于N原子来说,由于其最外层电子处于半充满的稳定状态,所以失去电子需要的能量比O还多。因此这三种元素的电负性由大到小的顺序是N>O>C。(5) 根据四羰基镍的性质可推知该晶体所以分子晶体。(6)Fe:8×1/8+6×1/2=4;N:1。因此该磁性材料的化学式为Fe4N。 |
相似问题
下表是元素周期表的一部分 针对所给的元素 完成下列各小题。ⅠAⅡAⅢAⅣAⅤAⅥAⅦA2 CNO
下表是元素周期表的一部分,针对所给的元素,完成下列各小题。ⅠAⅡAⅢAⅣAⅤAⅥAⅦA2CNO3NaAlSiSCl21 第3周期中金属性最强的元素是(填元素名称)。22
氯元素的相对原子质量为35.5 氯只有35Cl和37Cl两种稳定同位素 在氯气中35Cl和37Cl的
氯元素的相对原子质量为35.5,氯只有35Cl和37Cl两种稳定同位素,在氯气中35Cl和37Cl的原子个数比为3∶1,则相对分子质量为70,72,74的氯气分子数之比可能
短周期中的A B C D E五种元素 原子序数依次增大 A和D C和E分别同主族 A为非金属元素 且
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电
(12分)【化学——物质结构与性质】铜单质及其化合物在很多领域有重要用途 如金属铜用来制造电线电缆
(12分)【化学——物质结构与性质】铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,无水合硫酸铜可用作杀菌剂等。(1)Cu2+的核外电子
(15分)铜是过渡金属元素 可以形成多种化合物。(1)CuCl的盐酸溶液能够与CO发生反应:CuCl
(15分)铜是过渡金属元素,可以形成多种化合物。(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O①电负性:C ______O(填“>”或“












