硝酸发生氧化还原反应的时候 一般硝酸浓度越稀 对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的
| 硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示: (1)和铝粉和铁粉的混合物反应时,HNO3对应还原产物为______(填化学式); (2)完成下列过程中的离子反应方程式: O→C______;D→E______;E→F______; (3)B值是多少mol?写出计算过程. 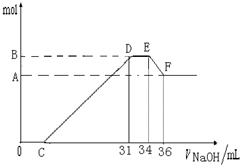 |
参考解答
| (1)HNO3的还原产物有N2O,NO,NO2,NH4+等,其中,铵根可以保留在溶液中,且可以与氢氧化钠反应,D与E一段氢氧化钠被消耗,但没有和氢氧化铝反应,从题干中可以知道,硝酸反应没有气体产生,由此可以肯定还原产物为硝酸铵. 故答案为:NH4NO3; (2)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,离子方程式为H++OH-═H2O, D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为,NH4++OH-═NH3?H2O, E与F之间沉淀的量减少,肯定是因为Al(OH)3溶解在氢氧化钠溶液中,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O 故答案为:H++OH-═H2O;NH4++OH-═NH3?H2O;Al(OH)3+OH-=AlO2-+2H2O; (3)E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中, 其反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O, 氢氧化铝与氢氧化钠物质的量之比为1:1, EF段的n(NaOH)=4mol/L×2×10-3L=0.008mol, Al(OH)3+NaOH→NaAlO2+2H2O 1 mol 1mol 0.008 mol 0.008mol Al(OH)3的量是0.008mol,所以Al3+也是0.008mol. 所以B与A差值为0.008mol 然后看D与E一段氢氧化钠被消耗, 但没有和氢氧化铝反应,从题干中可以知道 硝酸反应没有气体产生,由此可以肯定还原产物为硝酸铵. DE段分析如下,是NH4NO3和NaOH反应 NH4NO3~NaOH 1 mol 1mol n(NH4NO3)=n(NaOH)=(34-31)×10-3L×4mol/L=0.012mol 所以铁和铝开始和硝酸反应的时候生成三价离子,N元素变成铵根离子 铁离子和铝离子失去3e,N元素从+5变成-3价得8e 设铁有xmol,Al离子也是0.008mol,NH4+有0.012mol,根据电子守恒可得: 3x+0.008×3=0.012×8 x=0.024mol, 所以铁离子有0.024mol,那么氢氧化铁有0.024mol,氢氧化铝0.008mol, 则沉淀量最多的时候是0.032mol, 答:B值是0.032mol. |
相似问题
含有amol FeBr2的溶液中 通入xmol Cl2.下列各项为通Cl2过程中 溶液内发生反应的离
含有amolFeBr2的溶液中,通入xmolCl2.下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )A.x=a,2Fe2++2Br-+2Cl2═Br2+2Fe3+
下列各组中两种物质在溶液中的反应可用同一离子方程式表示的是( )A.Cu(OH)2+HCl;
下列各组中两种物质在溶液中的反应可用同一离子方程式表示的是( )A.Cu(OH)2+HCl;Cu(OH)2+CH3COOHB.NaHCO3+H2SO4;Na2CO3+HClC.NaHCO3+NaOH
(1)在一烧杯中盛有稀H2SO4 溶液 同时有一表面光滑的塑料小球悬浮于溶液中央 (如图).向该烧杯
(1)在一烧杯中盛有稀H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,(如图).向该烧杯里缓缓注入与稀H2SO4等密度的Ba(OH)2溶液至恰好完全
有一瓶澄清的溶液 其中可能含NH4+ K+ Mg2+ Ba2+ Al3+ SO42- CO32-中的
有一瓶澄清的溶液,其中可能含NH4+、K+、Mg2+、Ba2+、Al3+、SO42-、CO32-中的一种或几种,取该溶液进行如下实验:①取部分溶液,逐滴加入稀NaOH溶液,使
下列离子方程式中 不正确的是( )A.次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+2CO
下列离子方程式中,不正确的是( )A.次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+2CO2+2H2O=Ca(HCO3)2+2HClOB.硫酸亚铁的酸性溶液中加入H2O2溶液:












