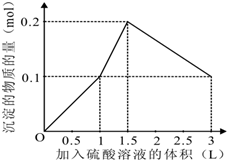
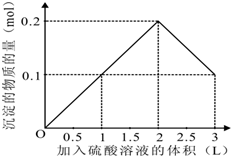
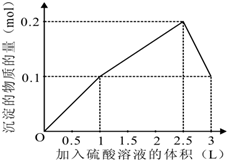
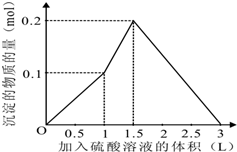
在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中 逐滴加入浓度为0.1m
在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1mol/L的H2SO4溶液,下列图象中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是( )
|
参考解答
| 在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中n(NaAlO2)=0.1mol,n[Ba(OH)2=0.1mol,向该混合溶液中加入H2SO4溶液,首先发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,Ba(OH)2反应完毕,继续加入H2SO4溶液,再发生反应AlO2-+H++H2O=Al(OH)3↓,AlO2-反应完毕,沉淀达最大,继续加入H2SO4溶液,发生反应Al(OH)3+3H+=Al3++3H2O,沉淀减少,Al(OH)3反应完毕,最后为BaSO4沉淀,继续加入H2SO4溶液,沉淀的量不变. 第一阶段:由发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O可知,Ba(OH)2反应完毕,需加入0.1molH2SO4,H2SO4溶液的体积为
第二阶段:由发生反应AlO2-+H++H2O=Al(OH)3↓可知,0.1molAlO2-反应完毕,该阶段需加入0.05molH2SO4,H2SO4溶液的体积为
第三阶段:由发生反应Al(OH)3+3H+=Al3++3H2O可知,沉淀减少,0.1molAl(OH)3完全溶解,该阶段需加入
由上述分析可知: 第一阶段产生沉淀n(BaSO4)=0.1mol,加入H2SO4溶液的体积为1L; 第二阶段又生成沉淀n[Al(OH)3=0.1mol,此时沉淀总量为0.2mol,该阶段加入H2SO4溶液的体积为0.1L,此时加入H2SO4溶液的总体积为1.5L; 第三阶段0.1molAl(OH)3完全溶解,此时沉淀n(BaSO4)=0.1mol,该阶段加入H2SO4溶液的体积为1.5L,此时加入H2SO4的总体积为3L. 故沉淀的量与H2SO4溶液体积关系图为: 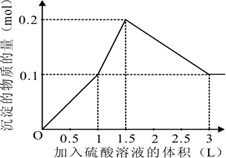 , 故选A. |
相似问题
下列表述正确的是( )A.氯气溶于水的离子方程式是Cl2+H2O=2H++Cl-+ClO-B.含有
下列表述正确的是( )A.氯气溶于水的离子方程式是Cl2+H2O=2H++Cl-+ClO-B.含有大量N03-的溶液中,可以同时大量存在H+、Fe2+、Cl-、SO42-C.常温下在
(普高完成)四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.元素ABCD性质或结构信息
(普高完成)四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.元素ABCD性质或结构信息室温下单质为黄色粉末状固体,加热易熔化;单质在
下列反应的离子方程式错误的是( )A.NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++H
下列反应的离子方程式错误的是( )A.NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-△ NH3↑+CO32-+2H2OB.Na2SO3溶液使酸性KMnO4溶液褪色
能用离子方程式OH-+H+═H2O表示的化学反应是( )A.氢氧化铜和稀盐酸反应B.Ba(OH)2
能用离子方程式OH-+H+═H2O表示的化学反应是( )A.氢氧化铜和稀盐酸反应B.Ba(OH)2溶液和稀硫酸反应C.KOH溶液和稀盐酸反应D.KOH溶液和CO2反应
下列反应的离子方程式正确的是( )A.Fe与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑B.C
下列反应的离子方程式正确的是( )A.Fe与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑B.CaCO3与稀硝酸反应:CO2-3+2H+═CO2↑+H2OC.H2SO4与KOH溶液中反应:H