(普高完成)四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.元素ABCD性质或结构信息
(普高完成)四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(2)写出C单质与水反应的化学方程式______.A与氢元素形成的化合物溶于水后,溶液的pH______7(填“大于”“等于”或“小于”). (3)D与酸反应的化学方程式为______与NaOH反应的离子方程式为______. (4)A、B两元素非金属性较强的是(写元素符号)______.写出其最高价氧化物对应水化物的酸性强弱______.(用化学式表示) |
参考解答
| 元素A单质室温下为黄色粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体,所以A为S元素; 元素B原子的M层上有7个电子,且单质常温、常压下是气体,能溶于水,所以B是Cl元素; C元素单质在空气中燃烧发出黄色的火焰,生成淡黄色的固体,单质质软、银白色固体、导电性强,所以C为Na元素; D元素原子最外电子层有4个电子,且是短周期元素,D元素为ⅣA元素,是C元素或Si元素,碳能与浓硫酸、浓硝酸反应,但不能与碱反应,硅能与HF酸反应,也能与NaOH反应,又因其单质既能与酸反应,又能与碱反应,所以为Si元素. (1)B是Cl元素,原子结构示意图为 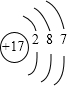 ,电子层数=周期数,最外层电子数=主族族序数,所以是第三周期第ⅦA族元素;Na与氧气燃烧后产物为Na2O2,电子式是 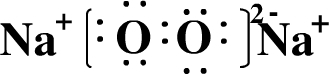 ,故答案为:第三周期第第ⅦA族; 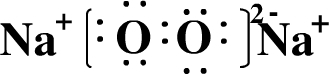 ; (2)C是钠,与水反应的方程式为:2Na+2H2O=2NaOH+H2↑,A是硫,与氢元素形成的化合物是H2S,溶于水后,溶液呈酸性,所以pH<7, 故答案为:2Na+2H2O=2NaOH+H2↑;小于; (3)D是Si,可以HF反应,反应方程式为:Si+4HF═SiF4↑+2H2↑,Si和强碱反应生成盐和氢气,所以离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑; 故答案为:Si+4HF═SiF4↑+2H2↑;Si+2OH-+H2O=SiO32-+2H2↑; (4)A是S元素,B是Cl元素,根据元素周期律知,氯元素非金属性大于硫元素; A、B两元素最高价氧化物对应水化物的酸分别是H2SO4、HClO4,HClO4的酸性>H2SO4的酸性. 故答案为:Cl;HClO4的酸性>H2SO4的酸性. |
相似问题
下列反应的离子方程式错误的是( )A.NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++H
下列反应的离子方程式错误的是( )A.NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-△ NH3↑+CO32-+2H2OB.Na2SO3溶液使酸性KMnO4溶液褪色
能用离子方程式OH-+H+═H2O表示的化学反应是( )A.氢氧化铜和稀盐酸反应B.Ba(OH)2
能用离子方程式OH-+H+═H2O表示的化学反应是( )A.氢氧化铜和稀盐酸反应B.Ba(OH)2溶液和稀硫酸反应C.KOH溶液和稀盐酸反应D.KOH溶液和CO2反应
下列反应的离子方程式正确的是( )A.Fe与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑B.C
下列反应的离子方程式正确的是( )A.Fe与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑B.CaCO3与稀硝酸反应:CO2-3+2H+═CO2↑+H2OC.H2SO4与KOH溶液中反应:H
下列离子方程式书写正确的是( )A.在FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2
下列离子方程式书写正确的是( )A.在FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-B.用石墨电极材料电解NaCl饱和溶液:2Cl-+2H2O通电
已知NaHCO3溶液和NaOH溶液反应的离子方程式为:HCO3-+OH-=CO32-+H2O NaH
已知NaHCO3溶液和NaOH溶液反应的离子方程式为:HCO3-+OH-=CO32-+H2O,NaHCO3在水中的电离方程式为:NaHCO3=Na++HCO3-,下列离子方程式不正确的是( )












