某固体混合物可能含Al (NH4)2SO4 MgCl2 A1Cl3 FeCl2 NaCl中的一种或几
| 某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几 种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积),回答下列问题: 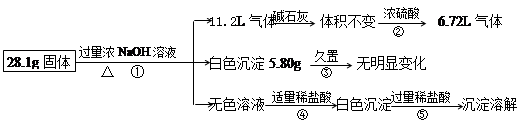 (1)混合物中是否存在FeCl2 ___(填“是”或“否”); (2)混合物中是否存在(NH4)2SO4 ___(填“是”或“否”),你的判断依据是 。 (3)写出反应④的离子反应式: 。 (4)请根据计算结果判断混合物中是否含有AlCl3_ _(填“是”或“否”),你的判断依据是 。 |
参考解答
| ⑴否 ⑵是,气体通过浓硫酸减少4.48L。 (3)H++OH-=H2O H2O+AlO2-+H+=Al(OH)3↓ (4)否,由题中信息可推得一定含有Al、(NH4)2SO4和MgCl2三种物质,而计算出三者质量之和刚好等于28.1g,所以原混合物中一定没有AlCl3。 |
试题分析:根据反应现象和化学计算判断物质的组成,根据加入氢氧化钠溶液得到白色沉淀,可推出无氯化亚铁;生成的气体通过碱石灰体积不变,而通过浓硫酸减少,说明气体中含有氨气,混合物中含有硫酸铵;③加入盐酸,先和①中过量的氢氧化钠反应,然后盐酸再与偏铝酸根反应,生成白色氢氧化铝沉淀;白色沉淀5.80g为氢氧化镁,可算出化合物中氯化镁的质量,气体通过浓硫酸减少4.48L,为氨气的体积,可求出硫酸铵的质量,剩余的6.72L气体为铝与氢氧化钠溶液反应生成的氢气,然后求出Al、(NH4)2SO4和MgCl2三者质量之和28.1g,正好等于原固体总质量,所以原混合物中一定不含AlCl3。 |
相似问题
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol
向100 mL 0 1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0 1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图
下列实验设计及其对应的离子方程式均正确的是A.Na2O2与H2O反应制备O2:Na2O2 + H2O
下列实验设计及其对应的离子方程式均正确的是A.Na2O2与H2O反应制备O2:Na2O2 + H2O= 2Na+ + 2OH- + O2↑ B.等体积、等浓度的Ca(HCO3)2溶液和
下列离子方程式书写正确的是( )A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2
下列离子方程式书写正确的是( )A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓C.三
下列实验现象与反应方程式或离子方程式 正确的是A.切开的金属Na暴露在空气中 光亮的表面逐渐变暗2N
下列实验现象与反应方程式或离子方程式,正确的是A.切开的金属Na暴露在空气中,光亮的表面逐渐变暗2Na+O2=Na2O2B.某溶液中加入BaCl2溶液,产生不溶于稀
下列反应的离子方程式书写正确的是
下列反应的离子方程式书写正确的是A.硫酸铜溶液中加过量的氨水:Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+B.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+==Ca












