向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )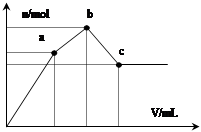
|
参考解答
| B |
试题分析:A项a点发生反应的离子方程式是:2Al3++3SO42-+3Ba2++6OH-= 2Al(OH)3↓+3BaSO4↓,错误;B项b点两者恰好完全反应:Al3++ NH4++2SO42-+2Ba2++4OH-= Al(OH)3↓+2BaSO4↓+NH3·H2O,消耗Ba(OH)2是NH4Al(SO4)2的2倍,体积为200mL;C项从a→b发生反应的离子方程式为:2NH4++SO42-+Ba2++2OH-=2NH3·H2O+BaSO4↓;D项a点沉淀为0.01mol Al(OH)3、0.015mol BaSO4,质量为0.01×78g+0.015×233g=4.275g,c点沉淀为0.02mol BaSO4,质量为0.02×233g=4.66g,错误。 点评:图像与化学反应结合是难点,解题时一定要对出现的拐点进行分析。本题较为综合,属于难题。 |
相似问题
下列实验设计及其对应的离子方程式均正确的是A.Na2O2与H2O反应制备O2:Na2O2 + H2O
下列实验设计及其对应的离子方程式均正确的是A.Na2O2与H2O反应制备O2:Na2O2 + H2O= 2Na+ + 2OH- + O2↑ B.等体积、等浓度的Ca(HCO3)2溶液和
下列离子方程式书写正确的是( )A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2
下列离子方程式书写正确的是( )A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓C.三
下列实验现象与反应方程式或离子方程式 正确的是A.切开的金属Na暴露在空气中 光亮的表面逐渐变暗2N
下列实验现象与反应方程式或离子方程式,正确的是A.切开的金属Na暴露在空气中,光亮的表面逐渐变暗2Na+O2=Na2O2B.某溶液中加入BaCl2溶液,产生不溶于稀
下列反应的离子方程式书写正确的是
下列反应的离子方程式书写正确的是A.硫酸铜溶液中加过量的氨水:Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+B.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+==Ca
下列解释物质用途的反应方程式不正确的是A.用Fe2(SO4)3净水 Fe3+ + 3H2O Fe(O
下列解释物质用途的反应方程式不正确的是A.用Fe2(SO4)3净水 Fe3+ + 3H2O Fe(OH)3 + 3H+B.用Na2S处理含Hg2+废水 Hg2+ + S2-HgS↓C.用Na2CO3溶












