高铁酸钾广泛应用于净水 电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如
高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下: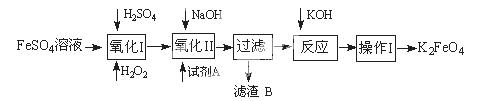 查资料得知K2FeO4的一些性质: ①在碱性环境中稳定,在中性和酸性条件下不稳定 ②溶解度很大,难溶于无水乙醇等有机溶剂 ③具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液 回答下列问题: (1)写出“氧化I”中,生成Fe3+的离子反应方程式 。 (2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaClO”);过滤操作中,得到的滤渣B中除NaCl还有 (3)操作I中包括冷却结晶、过滤、洗涤干燥几个步骤。洗涤干燥的目的是脱碱脱水,进行该操作时最好用 洗涤。 (4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式: K2FeO4 + H2O = Fe(OH)3↓ + KOH + (5)将一定量的K2FeO4投入一定浓度的FeCl3溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是 。 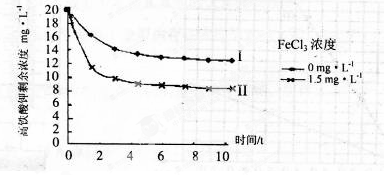 |
参考解答
| (16分) (1)H2O2+2H++2Fe2+=2Fe3++2H2O(3分,配平错扣1分) (2)NaClO Na2SO4(各2分,共4分) (3)无水乙醇(3分) (4)4 10 4 8 3O2 ↑ (产物正确1分,共3分) (5)FeCl3溶液水解显酸性,促进K2FeO4与水反应,从而降低K2FeO4浓度(3分) |
试题分析:(1)原料为硫酸亚铁溶液,所含亚铁离子具有还原性,硫酸是强酸,提供氢离子,不仅能抑制亚铁离子和铁离子的水解,而且能增强过氧化氢的氧化能力,使亚铁离子氧化为铁离子,根据化合价升降法、电荷守恒、原子守恒配平,则氧化I中生成铁离子的离子方程式为H2O2+2H++2Fe2+=2Fe3++2H2O;(2)由于目标产物是K2FeO4,它在碱性环境中稳定,在中性和酸性条件下不稳定,则氧化II中加入的氧化剂不能使H2O2,因为H2O2在碱性条件下的氧化性比酸性条件下弱,试剂A也不能是HNO3,因为酸性条件下Na2FeO4不稳定,试剂A只能是 NaClO,氧化II中反应为2NaOH+H2SO4=Na2SO4+2H2O、Fe2(SO4)3+3NaClO+10NaOH==2Na2FeO4+3NaCl+3Na2SO4+5H2O;根据已知信息可知,K2FeO4的溶解度很大,由此类推Na2FeO4的溶解度很大,为了从Na2FeO4、NaCl、Na2SO4、NaClO(过量)、NaOH(过量)组成的混合溶液中分离出Na2FeO4、NaOH(过量),则过滤所得滤渣的主要成分为NaCl、Na2SO4、NaClO(过量),除去它们之后所得的Na2FeO4、NaOH(过量)溶液用于制备K2FeO4;(3)Na2FeO4、NaOH(过量)溶液中加入过量KOH时的反应为:Na2FeO4+2KOH= K2FeO4+2NaOH,所得溶液经过蒸发浓缩、冷却结晶、过滤、洗涤可得K2FeO4晶体;由于K2FeO4的溶解度很大,难溶于无水乙醇等有机溶剂,且具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液,除去碱的同时,为了减少洗涤晶体造成K2FeO4的损失,最好选择无水乙醇洗涤K2FeO4晶体;(4)观察可得,该反应中铁元素由+6价将为+3价,钾元素、氢元素的化合价都没有变化,根据氧化还原反应的特征推断,化合价升高的元素只能是氧,氧元素由—2价升为其相邻的0价,则缺项物质为氧气,根据化合价升降法、原子守恒配平可得:4K2FeO4+10H2O==4Fe(OH)3↓ +8KOH+3O2↑;(5)根据已知信息可知,K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定,氯化铁是强酸弱碱盐,能水解,导致其溶液显弱酸性,K2FeO4在酸性条件下不稳定,酸性越强,K2FeO4越不稳定,反应速率越大,剩余K2FeO4的浓度越小。 |
相似问题
下列离子方程式中 正确的是( )A.将少量铜屑放入浓硝酸中:Cu+4H++2NO3-=Cu2
下列离子方程式中,正确的是()A.将少量铜屑放入浓硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2OB.向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-=Al(O
下列离子方程式书写正确的是( )A.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+
下列离子方程式书写正确的是()A.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-B.FeSO4溶液中加入酸性K2Cr2O7溶液:6Fe2
下列离子方程式正确的是 A.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2O
下列离子方程式正确的是A.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2OB.钠与水反应: Na+2H2O=Na++2OH-+H2↑C.碳
下列离子方程式正确的是A.过量乙酸与碳酸钠溶液反应:2H++CO== CO2↑+ H2OB.溴乙烷在
下列离子方程式正确的是A.过量乙酸与碳酸钠溶液反应:2H++CO== CO2↑+ H2OB.溴乙烷在NaOH水溶液中加热: CH3CH2Br + NaOH →CH2=CH2↑+NaBr +
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:①氯气与冷的氢氧化钠溶液反应生成Na
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:①氯气与冷的氢氧化钠溶液反应生成NaC1O;氯气与热的氢氧化钠溶液反应可生成NaC1O和N












