水是生命之源 与人类的生活密切相关。在化学实验和科学研究中 水有多种用途。(1)下列说法中正确的是
| 水是生命之源,与人类的生活密切相关。在化学实验和科学研究中,水有多种用途。 (1)下列说法中正确的是 (填序号)。
(3)水分子在特定条件下易形成水合氢离子(H3O+)。其中含有的化学键为 。 (4)如果需要增大水的电离程度,除了升高温度外,还可以采用的方法有 (回答一种即可)。若室温时,将某一元酸HA加水配成0.1 mol·L-1的稀溶液,此时HA在水中有0.1%发生电离,则由HA电离出的c(H+)约为水电离出的c(H+)的 倍。 (5)将一定量的Na2SO3固体溶于水,所得溶液中的电荷守恒关系式为 。 (6)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差异进行发电。已知该电池用金属银做负极,正极反应为5MnO2 +2Na++2e- 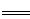 Na2Mn5O10,请写出电池总反应式 。 Na2Mn5O10,请写出电池总反应式 。 |
参考解答
| (1)C(2分) (2)V形(2分) (3)极性键、配位键(2分) (4)加入可水解的盐(或答具体的物质) 106 (各2分,共4分) (5)c(Na+)+c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-) (2分) (6)5MnO2 +2Ag +2NaCl  Na2Mn5O10+2AgCl (2分) Na2Mn5O10+2AgCl (2分) |
试题分析:(1)氢键存在于水分子之间,故A错误;水分子稳定和范德华力无关,跟水分子内部的共价键有关,故B错误;C正确,冰融化属于物理变化,破坏的是分子间作用力,共价键没有发生变化,故D错误; (2)水分子中氧原子含有2个σ键和2个孤对电子,所以水分子是V型结构; (3)水合氢离子(H3O+)中含有的化学键为极性键、配位键; (4)水的电离是吸热反应,升高温度促进水电离,酸或碱抑制水电离,含有弱根离子的盐促进水电离;HA电离出的c(H+)为0.1mol·L-1×0.1%=10-4mol·L-1,水电离产生的氢离子浓度为10-10mol·L-1,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍; (5)Na2SO3溶液中存在水解平衡:SO32-+H2O  HSO3-+OH-,HSO3-+H2O HSO3-+OH-,HSO3-+H2O H2SO3+OH-,所得溶液中的电荷守恒关系式为c(Na+)+c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-); H2SO3+OH-,所得溶液中的电荷守恒关系式为c(Na+)+c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-); (6)负极发生反应的电极方程式为:Ag+Cl--e-=AgCl,负极发生反应的电极方程式加上正极发生反应的电极方程式,就得到总反应方程式,5MnO2 +2Ag +2NaCl  Na2Mn5O10+2AgCl。 Na2Mn5O10+2AgCl。 |
相似问题
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂 其分子结构如图所示。常温下 S2Cl2遇水易水解
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2遇水易水解,并产生能使品红褪色的气体。下列说法错误的是()A.S2
下列推断正确的是 ( )A.BF3是三角锥形分子B.NH的电子式: 离子呈平面形结构C.CH4分
下列推断正确的是 ( )A.BF3是三角锥形分子B.NH的电子式:,离子呈平面形结构C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的s&sh
下列说法正确的是A.电负性最大的原子价电子构型:3S23p5B.N3- CO2和O3互为等电子体 所
下列说法正确的是A.电负性最大的原子价电子构型:3S23p5B.N3-、CO2和O3互为等电子体,所以它们空间构型都是直线型C.共价键和离子键都既有方向性又有饱
下列离子中 电子数大于质子数且质子数大于中子数的是[ ]A.D3O+ B.Li+ C.ODˉ
下列离子中,电子数大于质子数且质子数大于中子数的是[ ]A.D3O+ B.Li+ C.ODˉ D.OHˉ
按要求完成下列问题。(1)写出Mg2+的电子排布式
按要求完成下列问题。(1)写出Mg2+的电子排布式。(2)依次指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:________、________、________。(3)判断












