X Y Z W R是五种短周期元素 其原子序数依次增大.X是周期表中原子半径最小的元素 Y元素原子的
| X、Y、Z、W、R是五种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y元素原子的最外层电子数是其次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.请填写下列空白: (1)画出W的原子结构示意图;______. (2)Z和W最高价氧化物的水化物的碱性较强的是:______(写化学式),它们之间在溶液中反应的离子方程式是;______; (3)Z2Y2中阴离子的化学式是______. (4)在同周期元素中,R 元素及与其相邻元素的原子半径从大到小的顺序是:______.与R元素同周期且非金属性最强的元素是:______. (5)W的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,其反应的化学方程式是:______. |
参考解答
| X、Y、Z、W、R是五种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,则X为氢元素;Y元素原子的最外层电子数是其次外层电子数的3倍,则Y有2个电子层,最外层电子数为6,则Y为氧元素;R与Y处于同一族,则R为硫元素,Z、W、R处于同一周期,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,Z、W的原子序数小于R的原子序数,原子序数Z<W,故Z为钠元素,W为铝元素. 故X为氢元素;Y为氧元素;Z为钠元素,W为铝元素,R为硫元素. (1)W为Al元素,原子核外有13个电子,有3个电子层,最外层有3个电子,原子结构示意图 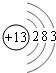 ,故答案为:  ; (2)Z为钠元素,W为铝元素,同周期自左而右金属性减弱,所以金属性Na>Al,金属性越强,最高价氧化物的水化物的碱性越强,所以碱性NaOH>Al(OH)3;氢氧化钠与氢氧化铝反应生成偏铝酸钠与氢气,在溶液中反应的离子方程式是 Al(OH)3+OH-=AlO2-+2H2O, 故答案为:NaOH;Al(OH)3+OH-=AlO2-+2H2O; (3)Z2Y2是Na2O2,阴离子的化学式是O22-,故答案为:O22-; (4)R为硫元素,在同周期元素中,与S元素相邻元素为P元素、Cl元素,同周期自左而右原子半径减小,所以从大到小的顺序是P>S>Cl.同周期自左而右非金属性增强,所以与S元素同周期且非金属性最强的元素是氯元素,故答案为:P>S>Cl;氯; (5)Al、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,为Al2O3、TiC,其反应的化学方程式为4Al+3C+3TiO2
故答案为:4Al+3C+3TiO2
|
相似问题
A B C D E F六种短周期主族元素的原子序数依次增大 且知:①A与B能形成多种气态化合物 B与
A、B、C、D、E、F六种短周期主族元素的原子序数依次增大,且知:①A与B能形成多种气态化合物,B与D能形成两种常见气态化合物,D与E能形成两种离子化合物
A B C D E F均为短周期元素 原子序数依次增大 A元素原子核内无中子.B元素原子核外最外层电
A、B、C、D、E、F均为短周期元素,原子序数依次增大,A元素原子核内无中子.B元素原子核外最外层电子数是次外层电子数的2倍.C元素是地壳中含量最多的元
X Y两元素的原子当它们分别获得1个电子后都能形成稀有气体的电子层结构 且X释放出的能量大于Y 下述
X、Y两元素的原子当它们分别获得1个电子后都能形成稀有气体的电子层结构,且X释放出的能量大于Y,下述不正确的是( )A.X-还原性大于Y-B.Y氧化性小
下列各组元素 不能形成AB2型化合物的是(数字表示核电荷数)( )A.6和8B.1和16C.12和
下列各组元素,不能形成AB2型化合物的是(数字表示核电荷数)( )A.6和8B.1和16C.12和9D.16和8
已知A B C D的原子序数都不超过18 它们的离子aA(n+1)+ bBn+ cC(n+1)- d
已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则下列叙述正确的是( )A.原子序数:












