A B C D E F均为短周期元素 原子序数依次增大 A元素原子核内无中子.B元素原子核外最外层电
| A、B、C、D、E、F均为短周期元素,原子序数依次增大,A元素原子核内无中子.B元素原子核外最外层电子数是次外层电子数的2倍.C元素是地壳中含量最多的元素.D是短周期元素中金属性最强的元素.E与D元素的质子数之和为27,最外层电子数之差为5.F元素的最高价氧化物的水化物为强酸. (1)推断B元素在周期表中的位置:第______周期______族. (2)写出F元素的电子排布式:______. (3)C、D元素可形成淡黄色的粉末,其电子式为______,所含化学键为______. (4)写出A与C元素形成10电子的微粒:______、______、______. (5)D、E元素形成的正盐的水溶液,阴离子的浓度大小顺序为:(从大到小排列)______. (6)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量.写出反应的热化学方程式:______. |
参考解答
| A、B、C、D、E、F均为短周期元素,原子序数依次增大.A元素原子核内无中子,则A为氢元素.B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为碳元素.C元素是地壳中含量最多的元素,则C为氧元素.D是短周期元素中金属性最强的元素,则D为钠元素.E与D元素的质子数之和为27,则E元素的质子数为27-11=16,则E为硫元素.F元素的最高价氧化物的水化物为强酸,原子序数比硫大,则F为氯元素. 即A为氢元素、B为碳元素、C为氧元素、D为钠元素、E为硫元素、F为氯元素. (1)B为碳元素,原子核外有2个电子层,最外层有4个电子,位于周期表第二周期第ⅣA族. 故答案为:二;ⅣA. (2)F为氯元素,原子核外有17个电子,电子排布式为1s22s22p63s23p5. 故答案为:1s22s22p63s23p5. (3)C为氧元素、D为钠元素,二者形成的淡黄色物质为Na2O2,Na2O2是离子化合物,由钠离子与过氧根离子构成, 电子式为 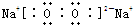 .钠离子与过氧根离子之间形成离子键,过氧根离子中氧原子之间形成1对共用电子对,是非极性共价键. 故答案为: 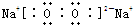 ;离子键、非极性共价键. (4)A为氢元素、C为氧元素,氢元素与氧元素形成10电子的微粒有H2O、H3+O、OH-. 故答案为:H2O、H3+O、OH-. (5)D为钠元素、E为硫元素,二者形成的正盐为Na2S,属于强碱弱酸盐,所以Na2S的水溶液中,S2-水解S2-+H2O?HS-+OH-,由于水解程度不大,所以离子浓度c(S2-)>c(HS-),由于溶液中存在水的电离,所以c(OH-)>c(HS-),水的电离程度不大,所以c(S2-)>c(HS-),所以阴离子的浓度大小顺序为c(S2-)>c(OH-)>c(HS-). 故答案为:c(S2-)>c(OH-)>c(HS-). (6)A为氢元素,C为氧元素,常温下,1mol氢气与氧气化合生成液态水,放出286kJ的热量,反应的热化学方程式为H2(g)+
故答案为:H2(g)+
|
相似问题
X Y两元素的原子当它们分别获得1个电子后都能形成稀有气体的电子层结构 且X释放出的能量大于Y 下述
X、Y两元素的原子当它们分别获得1个电子后都能形成稀有气体的电子层结构,且X释放出的能量大于Y,下述不正确的是( )A.X-还原性大于Y-B.Y氧化性小
下列各组元素 不能形成AB2型化合物的是(数字表示核电荷数)( )A.6和8B.1和16C.12和
下列各组元素,不能形成AB2型化合物的是(数字表示核电荷数)( )A.6和8B.1和16C.12和9D.16和8
已知A B C D的原子序数都不超过18 它们的离子aA(n+1)+ bBn+ cC(n+1)- d
已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则下列叙述正确的是( )A.原子序数:
U W X Y Z都是短周期元素 且原子序数依次增大.其中U与W可形成三角锥形分子A U与X可形成常
U、W、X、Y、Z都是短周期元素,且原子序数依次增大.其中U与W可形成三角锥形分子A,U与X可形成常温下呈液态的分子B,A、B均为10电子分子;Y元素原子的K层
在两种短周期元素组成的化合物中 若它们的原子个数之比为1:3 设这两种元素的原子序数分别为a和b 则
在两种短周期元素组成的化合物中,若它们的原子个数之比为1:3,设这两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是( )①a












