有A B C D E五种短周期元素 它们的核电荷数按C A B D E的顺序增大.C D都能分别与A
| 有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大.C、D都能分别与A按原子个数比为1:1或2:1形成化合物;CB可与EA2反应生成C2A和气态物质EB4;E的M层电子数是K层电子数的2倍. (1)写出下列元素的名称:A______,B______,E______. (2)画出E的原子结构示意图______. 写出电子式D2A2______,EB4______. (3)比较EA2与EB4的熔点高低(填化学式)______>______. (4)A的氢化物的沸点与同族下一周期元素的氢化物相比,A的氢化物的沸点______(填“高”或“低”),原因是______. |
参考解答
| E的M层电子数是K层电子数的2倍,K层容纳2个电子,M层有4个电子,则E为Si元素. A、B、C、D、E五种短周期元素,核电荷数按C、A、B、D、E的顺序增大.C、D都能分别与A按原子个数比为1:1或2:1形成化合物;CB可与EA2反应生成C2A和气态物质EB4;则C为H元素,A为O元素,D为Na元素; CB可与EA2反应生成C2A和气态物质EB4;该反应为4HF+SiO2═2H2O+SiF4↑,则B为F元素. 所以A为O元素,C为H元素,B为F元素,D为Na元素,E为Si元素. (1)由上述分析可知,A为O元素,名称为氧;B为F元素,名称为氟;E为Si元素,名称为硅. 故答案为:氧;氟;硅. (2)E为Si元素,质子数为14,最外层电子数为4,原子结构示意图为 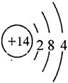 ; D2A2为Na2O2,由钠离子与过氧根离子构成,电子式为 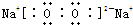 ; EB4为SiF4,硅原子与氟原子之间形成1对共用电子对,电子式为 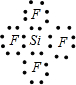 . 故答案为:  ; 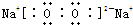 ;  . (3)EA2是SiO2,EB4是SiF4.SiO2为原子晶体,熔沸点较高,SiF4为分子晶体,熔沸点较低,沸点SiO2>SiF4. 故答案为:SiO2;SiF4. (4)A为O元素,对应氢化物为H2O,与A同族下一周期元素的氢化物为H2S,由于O元素的电负性很强,水分子之间形成氢键,而H2S中不存在氢键,所以水的沸点比H2S的沸点高. 故答案为:高;水分子之间形成氢键,而H2S中不存在氢键. |
相似问题
Q W X Y Z是原子序数依次增大的短周期元素 X Y是金属元素 X的焰色呈黄色 工业上一般通过电
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色,工业上一般通过电解氧化物的方法获得Y的单质.W、Z最外层电子数相同,Z
X Y Z W R是5种短周期元素 其原子序数依次增大.X+无电子 Y原子最外层电子数是次外层电子数
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X+无电子,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子
A B C D四种元素的原子序数均小于18 其最高正价数依次为1 4 5 7 已知B的原子核外次外层
A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1、4、5、7,已知B的原子核外次外层电子数为2.A、C原子的核外次外层电子数为8.D元素的最高
下列说法正确的是( )A.溶液中c(H+)>c(OH-) 该溶液不一定显酸性B.向沸腾的NaOH溶
下列说法正确的是( )A.溶液中c(H+)>c(OH-),该溶液不一定显酸性B.向沸腾的NaOH溶液中滴加FeCl3饱和溶液,可制备Fe(OH)3胶体C.主族元素的
X Y Z W是分别位于第2 3周期的元素 原子序数依次递增.X与Z位于同一主族 Y元素的单质既能与
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次












