A B C D四种元素的原子序数均小于18 其最高正价数依次为1 4 5 7 已知B的原子核外次外层
| A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1、4、5、7,已知B的原子核外次外层电子数为2.A、C原子的核外次外层电子数为8.D元素的最高价氧化物对应的水化物是已知含氧酸中最强的酸.则: (1)写出C元素原子的价电子轨道表示式______.写出D元素原子的电子排布式______. (2)已知B与氢元素形成的气态化合物在标准状况下的密度为1.161g?L-1,则在该化合物分子中B原子的杂化方式______,在该化合物分子中含有______个π键,含有______个σ键. (3)已知C、D两元素形成的化合物通常有CD3、CD5两种.这两种化合物一种为非极性分子,另一种为极性分子,则属于极性分子的化学式为______,该分子的空间构型为______. |
参考解答
| 已知B的原子核外次外层电子数为2,最高正价为4,则B为碳元素;A、C原子的核外次外层电子数为8,最高正价分别为1、5,则A为钠元素,C为磷元素;D元素的最高价氧化物对应的水化物是已知含氧酸中最强的酸,该酸为高氯酸,且Cl的最高价为+7,所以D为氯元素. (1)C为磷元素,最外层有5个电子,3s能级有2个电子,3p能级有3个电子,P原子的价电子轨道表示式为 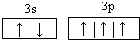 .D为氯元素,原子核外有17个电子,原子的电子排布式为1s22s22p63s23p5, 故答案为:  ;1s22s22p63s23p5; (2)B为碳元素,已知B与氢元素形成的化合物在标准状况下的密度为1.161g?L-1,该化合物的摩尔质量为1.161g?L-1×22.4L/mol=26g/mol,故该氢化物为C2H2,C原子杂化轨道数为1+1=2,C原子的杂化方式为sp杂化;分子后2个C-H键,1个C≡C键,单键为σ键,三键含有1个σ键、2个π键,所以在该化合物分子中含有 2个π键,含有3个σ键, 故答案为:sp;2;3; (3)C为磷元素、D为氯元素,CD3、CD5分别为PCl3、PCl5.PCl5中心原子P原子最外层电子全部成键为非极性分子,PCl3中心原子P原子最外层电子未全部成键为极性分子,P原子呈3个σ键、含有1对孤对电子对,采取sp3杂化,空间结构为三角锥型. 故答案为:PCl3;三角锥型. |
相似问题
下列说法正确的是( )A.溶液中c(H+)>c(OH-) 该溶液不一定显酸性B.向沸腾的NaOH溶
下列说法正确的是( )A.溶液中c(H+)>c(OH-),该溶液不一定显酸性B.向沸腾的NaOH溶液中滴加FeCl3饱和溶液,可制备Fe(OH)3胶体C.主族元素的
X Y Z W是分别位于第2 3周期的元素 原子序数依次递增.X与Z位于同一主族 Y元素的单质既能与
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次
A原子在核外第三层上有3个电子 B原子在核外第二层上有6个电子 它们组成稳定化合物的化学式是( )
A原子在核外第三层上有3个电子,B原子在核外第二层上有6个电子,它们组成稳定化合物的化学式是( )A.A2BB.ABC.A3B2D.A2B3
下列说法不正确的是( )A.元素周期表中 除第一和第七周期外 第n周期所含非金属元素(包括稀有气体
下列说法不正确的是( )A.元素周期表中,除第一和第七周期外,第n周期所含非金属元素(包括稀有气体元素)的种数均为(8-n)B.SiCl4、PCl3分子中各
T X G M N Q是元素周期中前20号的五种主族元素 它们的原子序数依次增大.T的一种原子原子核
T、X、G、M、N、Q是元素周期中前20号的五种主族元素,它们的原子序数依次增大.T的一种原子原子核内不含中子;X和M为同族元素,X的一种单质具有刺激性臭












