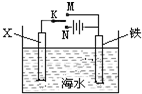
已知海水中含有的离子主要有Na+ Mg2+ Cl- Br- 利用右图装置进行实验探究 下列说法正确的
已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用右图装置进行实验探究,下列说法正确的是( )
 |
参考解答
| A.X为锌棒,K置于M,形成原电池,电解质溶液呈中性,发生吸氧腐蚀,铁电极上发生的反应为O2+4e-+2H2O=4OH-,故A错误; B.X为锌棒,K置于M,形成原电池,锌较活泼,应为负极,铁为正极,外电路电流方向是从铁到X,故B正确; C.X为碳棒,K置于N,为电解装置,铁为阴极,电源提供电子,铁被保护,难以腐蚀,为外加电流的阴极保护法,故C正确; D.X为碳棒,K置于N,X为阳极,在X电极周围首先失电子的是Br-,故D错误. 故选BC. |
相似问题
应用电解法制备的物质主要有三种:一是铝的工业制备;二是电解饱和NaCl溶液制备烧碱;三是金属钠的制备
应用电解法制备的物质主要有三种:一是铝的工业制备;二是电解饱和NaCl溶液制备烧碱;三是金属钠的制备.下列关于这三个工业生产的描述中正确的是(
下表为元素周期表的一部分 表中阿拉伯数字(1 2…)是 原周期表中行或列的序号。请参照元素A~I在表
下表为元素周期表的一部分,表中阿拉伯数字(1,2…)是 原周期表中行或列的序号。请参照元素A~I在表中的位置,回答下列问题: (1)B、C两元素中非金属性
早在1807年化学家戴维用电解熔融氢氧化钠的方法制得钠:4NaOH(熔融)4Na+O2↑+2H2O;
早在1807年化学家戴维用电解熔融氢氧化钠的方法制得钠:4NaOH(熔融)4Na+O2↑+2H2O;后来盖—吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4Na
工业上对海水资源综合开发利用的部分工艺流程如图所示.(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽
工业上对海水资源综合开发利用的部分工艺流程如图所示.(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽.离子膜和隔膜均允许通过的分子或离子是______
以Pt为电极 电解含有金属离子M+ N3+各0.10mol的溶液 阴极析出的金属单质或气体的总物质的
以Pt为电极,电解含有金属离子M+、N3+各0 10mol的溶液,阴极析出的金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图所示.对












