氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:依据上图 完成下列问题:(1)写出电解饱和
氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下: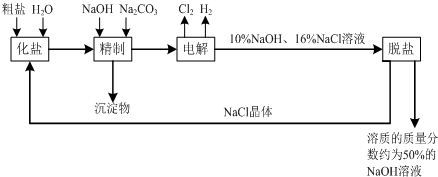 依据上图,完成下列问题: (1)写出电解饱和食盐水的离子方程式:______. (2)粗盐常含Ca2+、Mg2+、SO42-等杂离子,精制过程中要将它们以沉淀的形式除去,则加入试剂的合理顺序为______(填编号). A.先加入NaOH,后加入Na2CO3,再加入BaCl2溶液 B.先加入NaOH,后加入BaCl2溶液,再加入Na2CO3 C.先加入BaCl2溶液,后加入NaOH,再加入Na2CO3 (3)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______(填写操作名称)、冷却结晶、______(填写操作名称),除去NaCl. (4)由图示可知在电解制碱过程中______可以循环使用,以提高反应物利用率;在制碱的同时,还产生H2和Cl2,工业上常常利用它们生产______. (5)如图所示,目前电解法制烧碱通常采用离子交换膜法,阳离子交换膜不允许阴离子通过,阴离子交换膜不允许阳离子通过. 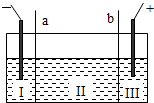 则以下叙述正确的是______(填编号). A.NaOH、H2均在Ⅰ区产生 B.图中a为阴离子交换膜,b为阳离子交换膜 C.Ⅲ区炭棒上的电极反应式为 2Cl--2e→Cl2↑ D.取少量Ⅲ区中的溶液,滴加酚酞,溶液变红色 (6)在实际生产中,经过脱盐后得到含溶质质量分数约为50%的NaOH溶液(密度为1.92g/cm3),则该烧碱溶液的物质的量浓度为______. |
参考解答
(1)电解氯化钠溶液的生成物是氢氧化钠、氯气和氢气,即:2Cl-+2H2O
(2)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去,加入Na2CO3的顺序必须在加入钡离子的后面即可,分析四个选项可知BC符合题意. 故答案为:BC; (3)因为氯化钠的溶解度随温度变化不大,所以可以采用蒸发溶剂结晶的方法,除去氢氧化钠中的氯化钠,故答案为:蒸发浓缩;过滤; (4)根据循环图,可以循环使用的物质是氯化钠,工业上可以用氯气和氢气反应生成氯化氢来生产盐酸,故答案为:NaCl;盐酸; (5)A、根据电解的工作原理:阳极放电的是氯离子,生成氯气,阴极放电的是氢离子,生成氢气,氢氧根和钠离子结合生成氢氧化钠,故A正确; B、图中Ⅰ区产生了氢氧化钠,是氢离子放电的电极区域,钠离子可以通过a,所以a为阳离子交换膜,b为阴离子交换膜,故B错误; C、Ⅲ区炭棒是阳极,该极上的电极反应式为 2Cl--2e→Cl2↑,故C正确; D、Ⅲ区中生成的是氯气,和水反应生成盐酸和次氯酸,溶液显酸性,该溶液滴加酚酞,溶液无色,故D错误. 故选AC; (6)质量分数和物质的量浓度间的关系c=
故答案为:24.0mol/L. |
相似问题
通以相等的电量 分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液 若被还原的硝酸银和硝酸亚
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银):n(硝酸亚汞)=2
用石墨电极电解CuCl2溶液(如图).下列分析正确的是( )A.a端是直流电源的负极B.通电使Cu
用石墨电极电解CuCl2溶液(如图).下列分析正确的是( )A.a端是直流电源的负极B.通电使CuCl2发生电离C.阳极上发生的反应:Cu2++2e-=CuD.通电一
下图所示装置中 甲 乙 丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液 足量的CuSO4
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5 00%的NaOH溶液、足量的CuSO4溶液和100g10 00%的K2SO4溶液,电极均为石墨电极.(1)接通电源,经过
电解溶质质量分数为26.0%的饱和食盐水100g 通入0.200mol电子后溶液中NaOH的质量分数
电解溶质质量分数为26 0%的饱和食盐水100g,通入0 200mol电子后溶液中NaOH的质量分数的理论值是( )A.8 02%B.8 00%C.8 63%D.8 61%
下图为直流电源 为浸透饱和氯化钠溶液和酚酞试液的滤纸 为电镀槽.接通电路后发现上的c点显红色.为实现
下图为直流电源,为浸透饱和氯化钠溶液和酚酞试液的滤纸,为电镀槽.接通电路后发现上的c点显红色.为实现铁上镀锌,接通后,使c、d两点短路.下列叙述正












