硫酸亚铁晶体(FeSO4?7H2O)俗称绿矾 加热至高温会分解产生水 金属氧化物和非金属氧化物.某化
| 硫酸亚铁晶体(FeSO4?7H2O)俗称绿矾,加热至高温会分解产生水、金属氧化物和非金属氧化物.某化学兴趣小组的同学对绿矾分解产生的非金属氧化物作如下探究: (1)猜想与假设: 猜想1:非金属氧化物为SO2 猜想2:非金属氧化物SO3 猜想3:非金属氧化物SO2、SO3 (2)设计与实验: 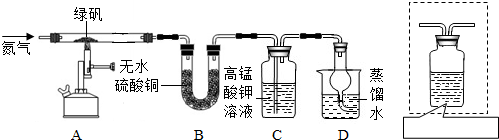 同学们设计了如图所示的实验装置(图中铁架台略去) 按上述装置进行实验,同学们观察到如下现象:装置B中硫酸铜粉末变蓝;绿矾完全分解后装置A中固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液;C中溶液褪色. ①由以上实验现象,可否认上述猜想中的______(填数字编号); ②小明同学从理论上分析得出:绿矾分解还生成另一物质SO3.请你说出他这样判断的理论依据是______; ③小明同学打算向装置D中滴入紫色石蕊试液以证明反应产生了SO3,小红认为此法不能达到实验目的,小红这样判断的理由是______; ④小红同学认为,在C、D之间连接图虚线方框内的装置,就可利用小明的方法证明反应产生了SO3.虚线方框内的仪器未画完整,请你帮她画完整并在装置图下的方框中注明药品的名称(气流方向:左→右). (3)结论与思考: ①利用小红的改进装置进行实验时,当观察到______后(填虚线方框装置中的现象),再在D中加入______(填试剂名称),若产生气泡,也可证明反应产生了SO3;②FeSO4高温加热分解的化学方程式为:______. |
参考解答
(2)①据无水硫酸铜白色粉末遇水变蓝,二氧化硫能使高锰酸钾溶液褪色,可否认猜想中的2; ②根据质量守恒定律,化学反应前后元素原子的种类个数不变,因每两个FeSO4分解生成1个Fe2O3后剩余S、O原子个数比为2:5不等于1:2,故可通过理论分析得出:绿矾分解还生成另一物质SO3,故答案为:每两个FeSO4分解生成1个Fe2O3后剩余S、O原子个数比为2:5不等于1:2; ③因三氧化硫溶于水和水反应生成酸,二氧化硫也能和水反应生成亚硫酸,故小红认为小明不能达到实验目的,这样判断的理由是SO2溶于水能够生成亚硫酸,亚硫酸可使紫色石蕊变红; ④据硫酸根离子的检验,瓶中物质应为氯化钡溶液, (3)①虚线方框装置中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊;再在D中加入碳酸钠,产生气泡,可证明反应产生了SO3;②据质量守恒定律,反应物、生成反应条件可写出方程式:2FeSO4
故答案为: (2)①2;②每两个FeSO4分解生成1个Fe2O3后剩余S、O原子个数比为2:5不等于1:2;③SO2溶于水能够生成亚硫酸,亚硫酸可使紫色石蕊变红;④ 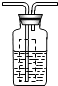 瓶内为BaC12溶液 瓶内为BaC12溶液(3)①溶液变浑浊,碳酸钠;②2FeSO4
|
相似问题
对“高低不同的燃烧的蜡烛 罩上烧杯后谁先熄灭?”这一问题 甲 乙两同学有不同的认识:甲同学认为高的蜡
对“高低不同的燃烧的蜡烛,罩上烧杯后谁先熄灭?”这一问题,甲、乙两同学有不同的认识:甲同学认为高的蜡烛先熄灭,乙同学认为低的蜡烛先熄灭,谁也说
为探究燃烧的有关条件 小红设计的实验如右图所示 在装置A中通入氧气 观察到白磷______.把A装置
为探究燃烧的有关条件,小红设计的实验如右图所示,在装置A中通入氧气,观察到白磷______.把A装置放入B的热水中,先不通入氧气,观察到白磷______;再通
物质发生化学变化的前后 总质量是否发生改变?是增加 减小还是不变?小刘 小李按以下步骤进行探究:(1
物质发生化学变化的前后,总质量是否发生改变?是增加、减小还是不变?小刘、小李按以下步骤进行探究:(1)提出假设:物质发生化学变化前后总质量不变。(2
为了研究质量守恒定律 设计了下图“白磷燃烧前后质量测定”的实验 请分析有关问题:(1)装置:锥形瓶的
为了研究质量守恒定律,设计了下图“白磷燃烧前后质量测定”的实验,请分析有关问题:(1)装置:锥形瓶的底部铺有一层细沙,其作用是____________。(2
某兴趣小组将大小相同的若干块棉布在五份不同体积分数的酒精溶液中浸透后取出点火 做了“烧不坏的棉布”的
某兴趣小组将大小相同的若干块棉布在五份不同体积分数的酒精溶液中浸透后取出点火,做了“烧不坏的棉布”的实验。其实验结果如下表:(1)你推测⑤的实验现












