(6分)(2012?重庆)向10mL 0.1mol?L﹣1 NH4Al(SO4)2溶液中 滴加等浓度
(6分)(2012?重庆)向10mL 0.1mol?L﹣1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL.下列叙述正确的是( )
|
参考解答
| A |
试题分析:当x=10时,NH4Al(SO4)2与Ba(OH)2等物质的量反应,此时OH﹣量不足,OH﹣首先与Al3+反应,与NH4+不反应,所以溶液中有未参加反应的NH4+和部分剩余的Al3+存在,同时SO42﹣也有剩余,但此时不会有AlO2﹣生成,结合铵根离子水解解答; 当x=30时,0.001 mol的NH4Al(SO4)2与0.003 mol Ba(OH)2反应,生成0.002 mol BaSO4、0.001 mol NaAlO2、0.001 mol NH3?H2O,且剩余0.001 mol Ba2+和0.001 mol OH﹣,由于NH3?H2O也是一种碱,存在电离平衡:NH3?H2O?NH4++OH﹣,据此判断反应中c(OH﹣)与c(AlO2﹣)、c(Ba2+)的大小关系. 解:A、当x=10时,NH4Al(SO4)2与Ba(OH)2等物质的量反应,此时OH﹣量不足,OH﹣首先与Al3+反应,与NH4+不反应,所以溶液中有未参加反应的NH4+和部分剩余的Al3+存在,同时SO42﹣也有剩余,但此时不会有AlO2﹣生成,溶液中c(NH4+)>c(Al3+),故A正确; B、由A中分析可知,溶液中不会有AlO2﹣生成,溶液中有NH4+、Al3+、SO42﹣,参加反应的硫酸根离子为0.001mol,剩余0.001molSO42﹣,溶液中NH4+未参加反应,但溶液中NH4+水解,故c(NH4+)<c(SO42﹣),故B错误; C、当x=30时,0.001 mol的NH4Al(SO4)2与0.003 mol Ba(OH)2反应,生成0.002 mol BaSO4、0.001 mol NaAlO2、0.001 mol NH3?H2O,且剩余0.001 mol Ba2+和0.001 mol OH﹣,由于NH3?H2O也是一种碱,存在电离平衡:NH3?H2O?NH4++OH﹣,使得溶液中c(OH﹣)大于0.001 mol,故c(OH﹣)>c(AlO2﹣),故C错误; D、由C中分析可知,溶液中含有Ba2+、AlO2﹣、OH﹣,其中溶液中c(OH﹣)大于0.001 mol,含有0.001 mol Ba2+,c(OH﹣)>c(Ba2+),故D错误; 故选A. 点评:本题考查离子方程式的有关计算、过量计算等,难度中等,清楚氢氧根离子与铵根离子、铝离子反应的先后顺序是解题的关键. |
相似问题
下列说法正确的是[ ]A.氧化还原反应的本质是元素化合价发生变化B.发生氧化反应的是得到电子
下列说法正确的是[ ]A.氧化还原反应的本质是元素化合价发生变化B.发生氧化反应的是得到电子的物质 C.物质所含元素化合价升高的反应是还原反应 D.
下列离子方程式书写不正确的是 ( )。A.NaOH溶液与SO2反应 当n
下列离子方程式书写不正确的是 ( )。A.NaOH溶液与SO2反应,当n(NaOH)∶n(SO2)=4∶3时,4OH-+3SO2= SO32—+2HSO3—+H2OB.CuCl2溶液与Na2S溶液
神舟十号飞船是中国“神舟”号系列飞船之一 它是中国第五艘搭载太空人的飞船。神舟十号飞船发射成功后 将
神舟十号飞船是中国“神舟”号系列飞船之一,它是中国第五艘搭载太空人的飞船。神舟十号飞船发射成功后,将与2011年发射升空的天宫一号目标飞行器进行交
某厂废水中含5.00×10-3 mol·L-1的Cr2O 其毒性较大。某研究性学习小组为了变废为宝
某厂废水中含5 00×10-3 mol·L-1的Cr2O,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0 5Fe1 5FeO4(Fe的化合价依次为+3、
下列离子方程式不正确的是 A.向FeBr2溶液中通入足量氯气:2Fe
下列离子方程式不正确的是A.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-B.在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-=


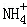 、Al3+、
、Al3+、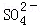 ,且c(
,且c(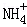 )>c(Al3+)
)>c(Al3+)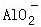 、
、









