某厂废水中含5.00×10-3 mol·L-1的Cr2O 其毒性较大。某研究性学习小组为了变废为宝
某厂废水中含5.00×10-3 mol·L-1的Cr2O,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程: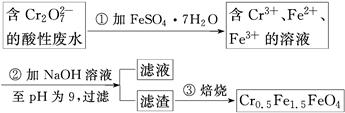 (1)第①步反应的离子方程式是________________________________________________。 (2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有__________。 (3)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________g FeSO4·7H2O。 |
参考解答
| (1)Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O (2)Fe(OH)3、Fe(OH)2 (3)13.9 |
| (1)第①步是Cr2O72-与Fe2+发生氧化还原反应,离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;(2)从最终所得磁性材料的化学式可知,滤渣中主要有Cr(OH)3、Fe(OH)2、Fe(OH)3;(3)1 L废水中的n(Cr2O72-)=5.00×10-3mol,根据关系式:Cr2O72-~4Cr0.5Fe1.5FeO4~10FeSO4·7H2O,所以理论上n(FeSO4·7H2O)=0.05 mol,m(FeSO4·7H2O)=0.05 mol×278 g·mol-1=13.9 g。 |
相似问题
下列离子方程式不正确的是 A.向FeBr2溶液中通入足量氯气:2Fe
下列离子方程式不正确的是A.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-B.在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-=
(10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行 即煅烧 催化氧化 吸收。请回答下列个问题
(10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列个问题:(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、
下列化工生产中所发生的主要化学反应 不涉及氧化还原反应的是[ ]A.制造普通玻璃 B.接触法
下列化工生产中所发生的主要化学反应,不涉及氧化还原反应的是[ ]A.制造普通玻璃 B.接触法制硫酸 C.工业冶炼铝 D.工业合成氨
能正确表示下列反应的离子方程式为A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH–= CO32-
能正确表示下列反应的离子方程式为A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH–= CO32-+ H2OB.二氧化硫通入次氯酸钠溶液:SO2+ ClO- + 2OH–=
下列离子方程式正确的是A.乙酸与碳酸钠溶液反应:2H++CO32—== CO2↑+H2OB.醋酸溶液
下列离子方程式正确的是A.乙酸与碳酸钠溶液反应:2H++CO32—== CO2↑+H2OB.醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2OC.苯酚钠溶












