[化学选修——3:物质结构与性质](15分)周期表前四周期的元素a b c d e 原子序数依次增大
| [化学选修——3:物质结构与性质](15分) 周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题: (1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。 (2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写两种)。 (3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式) (4)c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。 (5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。 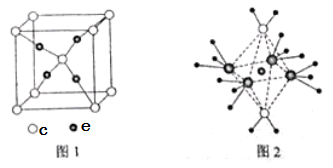 |
参考解答
(1)N  (2)sp3 H2O2、N2H4 (3)HNO2、HNO3 H2SO3 (4)+1 (5)SO42— 共价键和配位键 H2O H2O与Cu2+的配位键比NH3与Cu2+的弱 |
试题分析:根据题意知,周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其电子层数相同,则a为氢元素;b的价电子层中的未成对电子有3个,则b为氮元素;c的最外层电子数为其内层电子数的3倍,则c为氧元素;d与c同主族,则d为硫元素;e的最外层只有1个电子,但次外层有18个电子,则e为铜元素。(1)同周期由左向右第一电离能呈递增趋势,但当元素原子的轨道呈全满、全空、半充满状态时,较稳定;同主族由上到下第一电离能逐渐减小,氮原子2p轨道为半充满状态,较稳定,则N、O、S中第一电离能最大的是N;e为铜元素,价层电子轨道示意图为  。(2)a为氢元素,和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子为氨分子,中心原子的杂化方式为sp3;分子中既含有极性共价键,又含有非极性共价键的化合物是H2O2、N2H4、C2H6等。(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是HNO2、HNO3;酸根呈三角锥结构的酸是H2SO3。(4)根据O和Cu形成的离子化合物的晶胞结构判断,该化合物的化学式为Cu2O,则e离子的电荷为+1。(5)根据题给信息知,这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,为硫酸根;阳离子呈轴向狭长的八面体结构结合图2知,该化合物的化学式为[Cu(NH3)4(H2O)2SO4。则该化合物中阴离子为SO42—,阳离子中存在的化学键类型有共价键和配位键;该化合物加热时首先失去的组分是H2O,判断理由是H2O与Cu2+的配位键比NH3与Cu2+的弱。 。(2)a为氢元素,和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子为氨分子,中心原子的杂化方式为sp3;分子中既含有极性共价键,又含有非极性共价键的化合物是H2O2、N2H4、C2H6等。(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是HNO2、HNO3;酸根呈三角锥结构的酸是H2SO3。(4)根据O和Cu形成的离子化合物的晶胞结构判断,该化合物的化学式为Cu2O,则e离子的电荷为+1。(5)根据题给信息知,这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,为硫酸根;阳离子呈轴向狭长的八面体结构结合图2知,该化合物的化学式为[Cu(NH3)4(H2O)2SO4。则该化合物中阴离子为SO42—,阳离子中存在的化学键类型有共价键和配位键;该化合物加热时首先失去的组分是H2O,判断理由是H2O与Cu2+的配位键比NH3与Cu2+的弱。 |
相似问题
【物质结构与性质】根据元素周期表中第四周期元素的相关知识 回答下列问题:(1)第四周期元素的基态原子
【物质结构与性质】根据元素周期表中第四周期元素的相关知识,回答下列问题:(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有_____
运用元素周期律分析下列推断 其中错误的是A.铍是一种轻金属 它的氧化物的水化物可能具有两性B.砹单质
运用元素周期律分析下列推断,其中错误的是A.铍是一种轻金属,它的氧化物的水化物可能具有两性B.砹单质是一种有色固体,砹化氢很不稳定C.硒化氢(H2Se)
X元素的阳离子与Y的阴离子具有相同的核外电子排布 则下列比较中正确的是A.原子序数: X<YB.原子
X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是A.原子序数: X<YB.原子半径:X<YC.离子半径:X>YD.原子最外层电子数:X<Y
(12分)甲同学拟通过实验探究同主族元素性质的递变规律 以及影响化学反应速率的因素。其设计的实验方案
(12分)甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。实验室提
已知W X Y Z为短周期元素 它们的原子半径依次增大 W与Z X和Y分别同主族 Y Z同周期。X和
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期。X和Y能形成两种常见共价化合物,Z能与X形成两种常见的离子化












