(12分)甲同学拟通过实验探究同主族元素性质的递变规律 以及影响化学反应速率的因素。其设计的实验方案
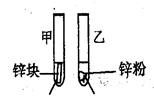
| (12分)甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。 实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/L盐酸、3mol/L的盐酸 (1)探究同主族元素性质的递变规律 ①写出下列实验报告中的实验现象和离子方程式 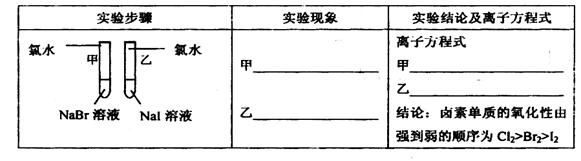 ②【评价】甲同学设计的实验方案的合理性是___________(填序号) A. 非常合理 B. 部分合理 C. 完全不合理 ③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。 (2)探究影响化学反应速率的因素
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。 |
参考解答
(1)①甲:溶液由无色变为橙色,离子方程式:Cl2+2Br-=2Cl-+Br2.乙:溶液 由无色变为黄色,离子方程式为:Cl2+2I-=2Cl-+I2。② B ;③ 溴水;(2)锌粉的表面积大,也能加快反应速率。(3)(图像3分)(正负极也可以用文字书写,正极材料、电解质溶液的选用合理即可。正负极材料、标正负极均正确给1分,电子移动方向正确给1分,电解质溶液正确给1分,若未形成闭合回路扣1分,即没画电解质或导线时。)负极:Zn - 2e-=Zn2+ 正极:Cu2+ + 2e-=Cu |
试题分析:(1)①由于非金属性Cl>Br>I,元素的非金属性越强,其单质的氧化性越强。活动性强的能把活动性弱的从化合物中置换出来。把氯气通入NaBr溶液中,氯气把溴单质置换出来,由于溴单质的水溶液为橙色。相应的离子方程式为Cl2+2Br-=2Cl-+Br2。把氯气通入NaI溶液中,氯气把碘单质置换出来,由于碘单质的水溶液为黄色。相应的离子方程式为Cl2+2I-=2Cl-+I2。②该方案只能证明Cl2>Br2,Cl2 >I2,但是不能证明Br2>I2,因此选项为B。③应该再补充一个实验,把溴水加入到NaI溶液中,若能发生置换反应,则证明Br2>I2。即Cl2>Br2 >I2。(2)Zn是固体,Zn粉的表面积比Zn块大,与同种浓度的盐酸接触面积大,实验反应速率快。而不是固体的浓度大引起的速率变化。(3)Zn、C作电极,电解质溶液为CuSO4,Zn、C连接起来同时插入CuSO4溶液。这时构成了原电池。Zn作负极,发生反应:Zn - 2e-=Zn2+。C为正极,在正极上发生反应:Cu2+ + 2e-=Cu。总方程式为Zn+Cu2+ ='Cu+' Zn2+。 |
相似问题
已知W X Y Z为短周期元素 它们的原子半径依次增大 W与Z X和Y分别同主族 Y Z同周期。X和
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期。X和Y能形成两种常见共价化合物,Z能与X形成两种常见的离子化
与的两种微粒 下列叙述正确的是( )A.一定都是由质子 中子 电子组成的B.化学性质几乎完全相同C
与的两种微粒,下列叙述正确的是()A.一定都是由质子、中子、电子组成的B.化学性质几乎完全相同C.核电荷数和核外电子数一定相等D.质子数一定相同,
X Y Z W均为短周期元素 它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ()A.原子半径:W>
几种短周期元素的原子半径及主要化合价如下表 由此可知 A.X Y元素的金属性:X
几种短周期元素的原子半径及主要化合价如下表,由此可知A.X、Y元素的金属性:X<YB.X、Z形成的化合物中一定不含共价键C.W的最高价氧化物的水化物是一种
Co是r射线的放射源 关于27Co的说法正确的是 A.质子数为 33B.中子数为27C.质量
Co是r射线的放射源,关于27Co的说法正确的是A.质子数为 33B.中子数为27C.质量数为60D.核电荷数为60