1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL 质量分数为63%的浓硝酸中 得到N
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
|
参考解答
| C |
本题考查有关合金的化学计算,意在考查考生的化学计算能力。设合金中Cu、Mg的物质的量分别为x、y,根据题目所给信息知x×64 g/mol+y×24 g/mol=1.52 g ①;设金属为M,在反应过程中有:M-ne-===Mn+,Mn++OH-===M(OH)n↓,从而可以看出,金属单质失去电子的物质的量等于金属阳离子完全沉淀所需OH-的物质的量,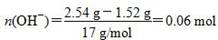 ,故2x+2y=0.06 mol ②,由①②解得x=0.02 mol,y=0.01 mol,显然A正确。 ,故2x+2y=0.06 mol ②,由①②解得x=0.02 mol,y=0.01 mol,显然A正确。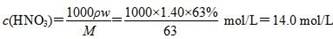 ,B正确。得到2.54 g沉淀时,消耗0.06 mol NaOH,其体积为60 mL,C错误。由上述分析可知,Cu、Mg共失去0.06 mol电子,根据得失电子守恒知,如果硝酸完全被还原为NO2,NO2的物质的量应为0.06 mol。现得到0.05 mol混合气体,是由于2NO2N2O4,由差量法可求得N2O4为0.01 mol,则NO2为0.04 mol,显然D正确。 ,B正确。得到2.54 g沉淀时,消耗0.06 mol NaOH,其体积为60 mL,C错误。由上述分析可知,Cu、Mg共失去0.06 mol电子,根据得失电子守恒知,如果硝酸完全被还原为NO2,NO2的物质的量应为0.06 mol。现得到0.05 mol混合气体,是由于2NO2N2O4,由差量法可求得N2O4为0.01 mol,则NO2为0.04 mol,显然D正确。 |
相似问题
高温下焙烧CuFeS2的反应之一为2CuFeS2+7O2=CuSO4+CuO+Fe2O3+3SO2
高温下焙烧CuFeS2的反应之一为2CuFeS2+7O2=CuSO4+CuO+Fe2O3+3SO2,下列关于该反应的叙述正确的是A.CuFeS2中硫的化合价为-1B.CuFeS2发生还原反应C.1 m
在汽车尾气处理装置中常发生如下反应:4CO+2NO2=4CO2+N2。下列对该反应的说法中正确的是A
在汽车尾气处理装置中常发生如下反应:4CO+2NO2=4CO2+N2。下列对该反应的说法中正确的是A.该反应属于置换反应B.该反应中氧化剂是CO,还原剂是NO2C.该
从淡化海水中提取溴的流程如图所示 下列有关说法错误的是A.X为SO2气体 也可将SO2换成Na2SO
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是A.X为SO2气体,也可将SO2换成Na2SO3B.设备Y为蒸馏塔C.在提取溴的过程中一定有Br-被氧化D.
2012年6月18日18时37分“神州九号”载人飞船顺利发射升空 13天后 返回舱于6月29日上午1
2012年6月18日18时37分“神州九号”载人飞船顺利发射升空,13天后,返回舱于6月29日上午10时许安全返回地面.“神舟九号”所用的改进型“长征二号”F遥八
化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。(1)催化
化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应












