(14分)为测定一置于空气中的某硫酸酸化的FeS04溶液中Fe2+被氧化的百分率 某同学准确量取pH
| (14分)为测定一置于空气中的某硫酸酸化的FeS04溶液中Fe2+被氧化的百分率,某同学准确量取pH=l(忽略Fe2+、Fe3+的水解)的FeS04溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeS04溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g。 (1)通过计算,填写下表:
(2)计算原溶液中Fe2+被氧化的百分率。 (3)当Fe2+部分被氧化时,试推导c(Fe2+、Fe3+)与c(H+)、c(SO42—)的关系。 |
参考解答
| (1)0.1mol/L 0.6mol/L 0.5moL/L (每空2分) (2)根据电荷守恒有: 2·c(Fe2+)+3·c(Fe3+)+c(H+)=2·c(SO42—) 代入(1)中所求数据: 2·c(Fe2+)+3·c(Fe3+)='1.1' mol/L 又c(Fe2+)+c(Fe3+)=0.5mol/L 解得:c(Fe2+)=0.4mo1/L,c(Fe3+)=0.1mol/L Fe2+被氧化的百分率为: 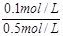 ×100%=20% ×100%=20%(3)若Fe2+没有被氧化,c(Fe2+、Fe3+)=c(SO42—)- 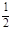 c(H+) c(H+)若Fe2+全部被氧化,c(Fe2+、Fe3+)= 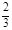 c(SO42—)- c(SO42—)-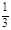 c(H+) c(H+)故当Fe2+部分被氧化时,c(Fe2+、Fe3+)与c(H+)、c(SO42—)的关系为: c(SO42—)- 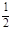 c(H+)> c(Fe2+、Fe3+)> c(H+)> c(Fe2+、Fe3+)>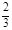 c(SO42—)- c(SO42—)-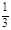 c(H+) c(H+) |
| (1)根据pH=1可知,溶液中氢离子浓度是0.1mol/L。28.0g沉淀是硫酸钡,物质的量是0.12mol,浓度是0.12mol÷0.2L=0.6mol/L。8.0g固体是氧化铁,物质的量是0.05mol,所以铁原子的物质的量是0.1mol,因此Fe2+和Fe3+的总的物质的量的浓度是0.1mol÷0.2L=0.5mol/L。 (2)根据电荷守恒进行计算 (3)可以依据极值法进行计算 |
相似问题
已知KClO3与浓HCl反应的化学方程式为:KClO3+6HCl=KCl+3C12↑+3H2O若用K
已知KClO3与浓HCl反应的化学方程式为:KClO3+6HCl=KCl+3C12↑+3H2O若用K35C1O3与H37Cl作用,则下列说法正确的是 ( )A.所得氯气的相对分子质量约为71B
为防治碘缺乏病 通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KI
为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O(1)该反应中,氧
铝可与硝酸钠发生反应(未配平):Al+NaNO+HOAl(OH)+N↑+NaAlO 有关叙述正确的是
铝可与硝酸钠发生反应(未配平):Al+NaNO+HOAl(OH)+N↑+NaAlO,有关叙述正确的是()A.上述反应中水是氧化剂B.若反应过程中转移5 mol e则生成标准
在2KNO3 + S + 3C===K2S + N2↑ + 3CO2↑的反应中 被2molKNO3氧
在2KNO3 + S + 3C===K2S + N2↑ + 3CO2↑的反应中,被2molKNO3氧化的C的质量是A.15gB.18gC.21gD.30g
高锰酸钾和浓盐酸可以发生下列反应:2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2K
高锰酸钾和浓盐酸可以发生下列反应:2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O(1)该反应的氧化剂是______,还原剂是________。(2)若消耗0 2 mol












