某反应中反应物与生成物有:AsH3 H2SO4 KBrO3 H3AsO4 H2O和一种未知物质X.(
| 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、H3AsO4、H2O和一种未知物质X. (1)已知KBrO3在反应中得到电子,则该反应的还原剂是______. (2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为:______. (3)根据上述反应可推知______. a.氧化性:KBrO3>H3AsO4 b.氧化性:KBrO3>KBrO3 c.还原性:ASH3>X d.还原性:X>ASH3 (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:______. 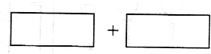 |
参考解答
| (1)KBrO3在反应中得到电子,则Br元素的化合价降低,给出的物质中AsH3具有还原性,As元素的化合价在反应中升高,故答案为:AsH3; (2)设X中Br元素化合价为x,由元素化合价的变化可知转移的电子为0.2mol×(5-x)=1mol,解得x=0,则X为Br2,故答案为:Br2; (3)在反应中,氧化剂为KBrO3,还原剂为AsH3,氧化产物为H3AsO4,还原产物为Br2, 由氧化剂的氧化性大于氧化产物的氧化性可知KBrO3>H3AsO4,由还原剂的还原性大于还原产物的还原性可知ASH3>X (Br2), 故答案为:ac; (4)KBrO3在反应中得到电子,AsH3具失去电子,转移的电子数为40e-,则标出电子转移的方向和数目为 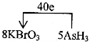 ,故答案为: 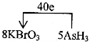 . |
相似问题
铜的冶炼大致可分为:(1)富集 将硫化物矿进行浮选(2)焙烧 主要反应:2CuFeS2+4O2=Cu
铜的冶炼大致可分为:(1)富集,将硫化物矿进行浮选(2)焙烧,主要反应:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣)(3)制粗铜,在1200 ℃发生的主要反应:2Cu2S
镍 钴 铈 铬虽然不是中学阶段常见的金属元素 但在工业生产中有着重要的作用。(1)二氧化铈 (CeO
镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用。(1)二氧化铈 (CeO2)是一种重要的稀土氧化物,在平板电视显示屏中有着
A B C D E为原子序数依次增大的五种短周期元素 其中仅含有一种金属元素 A和D最外层电子数相同
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电
a mol FeS与b mol FeO投入到V L c mol/L的硝酸溶液中充分反应 产生NO气体
a mol FeS与b mol FeO投入到V L、c mol L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还
4.6g铜镁合金完全溶解于100ml密度为1.40g/ml 质量分数为63%的浓硝酸中 得到4480
4 6g铜镁合金完全溶解于100ml密度为1 40g ml、质量分数为63%的浓硝酸中,得到4480mlNO2和336 ml N2O4的混合气体(标准状况),向反应后的溶液中加入1 0mo












