高锰酸钾是锸的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.(1)KMn
高锰酸钾是锸的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.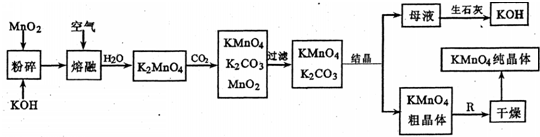 (1)KMn04是______(填颜色)的晶体,其稀溶液是一种常用的消毒剂.其消毒机理与下列______(填序号)物质相似.A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液) (2)写出K2Mn04溶液中通入CO2时发生的主要反应的离子方程式______ (3)上述流程图中:①可以循环使用的物质有生石灰、二氧化碳.Mn02和______(写化学式);②KMn04粗晶体变为KMnO4纯晶伴,需经过步骤R,R为______(填实验操作名称). (4)实际生产中,常用硫酸工业的废气(含S02)与该厂的废水(含KMnO4)按一定比例混合,以减少工业“三废”对环境的污染.写出KMnO4与SO2反应的离子方程式为______ (5)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得______mol KMn04. |
参考解答
| (1)高锰酸钾晶体是深紫色,KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故选:深紫色,BD; (2)反应中K2MnO4→KMnO4,Mn元素化合价由+6价升高为+7价,共升高变化1价,K2MnO4→MnO2,Mn元素化合价由+6价降低为+4价,共降低2价,化合价升降最小公倍数为2,故KMnO4系数为2,MnO2系数为1.根据Mn元素守恒可知KMnO4系数为3, 根据K元素守恒可知K2C03系数为2,由碳元素守恒可知系数C02为2,方程式为3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2. 故答案为:3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2. (3)制备中利用的原料,在转化过程中又生成的可以循环利用.由转化关系图知,除石灰、二氧化碳外,K2MnO4溶液中通入CO2以制备KMnO4生成的MnO2及最后由母液加入石灰生成的KOH,会在MnO2、KOH的熔融制备K2MnO4中被循环利用,故答案为:KOH; (4)二氧化硫具有还原性和KMnO4在水溶液中发生氧化还原反应,生成硫酸和硫酸锰,依据氧化还原反应电子守恒和原子守恒配平得到,5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+; 故答案为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+; (5)最初的原料中1mol MnO2恰好得到1mol KMnO4.由3K2MnO4+CO2=2KMnO4+K2CO3+MnO2知,1mol K2MnO4在反应中能得到
故答案为:
|
相似问题
在海水中提取溴的反应原理是5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O
在海水中提取溴的反应原理是5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O下列反应的原理与上述反应最相似的是( )A.2NaBr+Cl2=2NaCl+Br2B.2FeCl3+H2S=2F
氢气还原氧化铜:CuO+H2 △ . Cu+H2O 在该反应中( )A.Cu做还原剂B.CuO
氢气还原氧化铜:CuO+H2△ Cu+H2O,在该反应中( )A.Cu做还原剂B.CuO做氧化剂C.铜元素的化合价降低D.铜元素化合价升高
关于氧化还原反应的说法中正确的是( )A.氧化还原反应的本质是电子得失或偏移B.失去电子的物质是氧
关于氧化还原反应的说法中正确的是( )A.氧化还原反应的本质是电子得失或偏移B.失去电子的物质是氧化剂C.原子得到电子后,元素的化合价一定升高D
人体血红蛋白中应含Fe2+ 若食用亚硝酸盐 则导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒.服用
人体血红蛋白中应含Fe2+,若食用亚硝酸盐,则导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒.服用维生素C可解除亚硝酸盐中毒,下列叙述可能正确的是(
下列反应中 不属于氧化还原反应的是( )A.H2+Cl2=2HClB.2KMnO4 △ . K
下列反应中,不属于氧化还原反应的是( )A.H2+Cl2=2HClB.2KMnO4△ K2MnO4+MnO2+O2↑C.NH4HCO3△ NH3↑+CO2↑+H2OD.Zn+H2SO4═H2↑+ZnSO4












