(1)配平氧化还原反应方程式(2)称取6.0g含H2C2O4·2H2O KHC2O4和K2SO4的试
| (1)配平氧化还原反应方程式 |
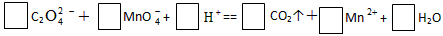 |
| (2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。 ①第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为__________mol。 ②第二份溶液滴加0.10 mol/L 酸性KMnO4溶液至16mL时反应完全,此时溶液颜色,由__________变为 ___________。该溶液中还原剂的物质的量________mol。 ③原试样中H2C2O4·2H2O的质量分数为_________,KHC2O4的质量分数为___________。 |
参考解答
| (1)5、2、16、10、2、8 (2)①0.005;②无色;紫红色;0.004;③21%;64% |
相似问题
下列电子转移的表示方法中正确的是[ ]A. B. C. D.
下列电子转移的表示方法中正确的是[ ]A B C D
科研人员将软锰矿(MnO2含量≥65% SiO2含量约20% A12O3含量约4% 其余为水分)和闪
科研人员将软锰矿(MnO2含量≥65%,SiO2含量约20%,A12O3含量约4%,其余为水分)和闪锌矿(ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分)同槽酸浸
在反应5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中 氧化剂是______
在反应5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,氧化剂是__________,还原剂是__________;氧化剂具有__________性;被氧化和被还原的原子数之比是__________。
FeS与一定浓度的HNO3反应 生成Fe(NO3)3 Fe2(SO4)3 NO2 N2O4 NO和H
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为4:1:4时,实际参加反应的FeS与HNO3的物质的量
将NO3-+ Zn +OH-+H2O → NH3 +Zn(OH)42-配平后 离子方程式中OH-的化
将NO3-+ Zn +OH-+H2O → NH3 +Zn(OH)42-配平后,离子方程式中OH-的化学计量数是[ ]A.1B.3 C.5 D.7












