(6分).在反应MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中 若二氧化锰与足量的浓盐酸反
(6分).在反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2,试求: MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2,试求:(1)反应消耗的氧化剂的质量; (2)反应消耗的HCl的物质的量。 |
参考解答
| (6分) (1)4.35克 (2)0.2mol |
试题分析: (1)n(Cl2)='3.55g÷71g/mol=0.05mol' ,氧化剂是二氧化锰。 MnO2+4HCl(浓) 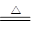 MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O1 1 n(MnO2) 0.05mol n(MnO2)=0.05mol m(MnO2)=0.05mol×87g/mol=4.35g (2)反应消耗的HCl的物质的量n(HCl)='4×0.05' mol=0.2mol 点评:直接根据方程式进行简单的化学计算,属于较简单题。 |
相似问题
实验室将NaClO3和Na2SO3按分子个数比为2∶1倒入烧瓶中 同时滴入适量硫酸 并用水浴加热 产
实验室将NaClO3和Na2SO3按分子个数比为2∶1倒入烧瓶中,同时滴入适量硫酸,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和 Na2SO3恰好完全反应,
Fe3P与稀HNO3反应生成Fe(NO3)3 NO H3PO4和H2O。(1) 写出反应的化学方程式
Fe3P与稀HNO3反应生成Fe(NO3)3、NO、H3PO4和H2O。(1) 写出反应的化学方程式:_______________________________________;(2) 上述反应中,当生成1 8 m
(8分)在xR2+ +yH+ +O2=mR3+ +nH2O的离子方程式中 (1)m=________
(8分)在xR2+ +yH+ +O2=mR3+ +nH2O的离子方程式中,(1)m=________(填数字)(2)R3+是___________(填氧化产物、还原产物)(3)用双线桥法表示电子转
锌与稀硝酸反应 若被氧化的锌与被还原的硝酸的物质的量之比为2:1 则该反应的还原产物为A.NOB.N
锌与稀硝酸反应,若被氧化的锌与被还原的硝酸的物质的量之比为2:1,则该反应的还原产物为A.NOB.N2OC.NO2D.Zn(NO3)2
(15分)I.磷 硫元素的单质和化合物应用广泛。(1)磷元素的原子结构示意图是 。(2)
(15分)I 磷、硫元素的单质和化合物应用广泛。(1)磷元素的原子结构示意图是。(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为












