(15分)I.磷 硫元素的单质和化合物应用广泛。(1)磷元素的原子结构示意图是 。(2)
| (15分)I.磷、硫元素的单质和化合物应用广泛。 (1)磷元素的原子结构示意图是 。 (2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为: 2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 , 10C+P4O10==P4+10CO 每生成 1molP4时,就有 mol电子发生转移。 (3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2 用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为: C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I- 在一定体积的某维生素C溶液中加入amolL-1I2溶液V1ml,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗bmolL-1 Na2S2O3溶液V2ml.该溶液中维生素C的物质量是 mol。 (4)在酸性溶液中,碘酸钠(KIO3)和亚硫酸钠可发生如下反映: 2IO3-+5SO32-+2H+==I2+5SO42++H2O 生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
II稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。 (5)在某强酸性混合稀土溶液中加入H2O2,调节pH ≈3. Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式: □Ce3++□H2O2+□H2O=====□Ce(OH)4↓+□ |
参考解答
(1)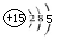 (2)20 (3) (2)20 (3)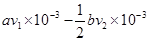 (4)温度、浓度对反应速率的影响 40 (5)(3分) 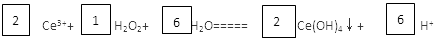 |
(1)磷元素位于第三周期、第ⅤA族,原子结构示意图为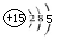 。 。(2)根据方程式可知,生成1mol白磷的同时,消耗10mol碳,所以转移的电子是10×(2-0)mol=20mol。 (3)反应中消耗的硫代硫酸钠的物质的量为0.001bv2mol,则剩余的单质碘是0.0005bv2mol。因此和维生素C反应的单质碘是0.001av1mol-0.0005bv2mol,所以维生素C的物质的量是0.001av1mol-0.0005bv2mol。 (4)根据实验数据可知,实验目的验证外界条件温度和浓度对反应速率的影响。实验1和2是检验浓度对反应速率的影响。实验2和3则是验证温度对反应速率的影响,因此溶液的浓度应该是相同的,所以体积是40ml。 (5)考查氧化还原反应方程式的配平。在氧化还原反应中电子的得失一定是守恒的,据此可以配平。双氧水是氧化剂,氧元素的化合价由-1价降低到-2价,1mol双氧水得到2mol电子。Ce3+是还原剂,化合价由+3价升高到+4价,失去1个电子,所以还原剂和氧化剂的物质的量之比是2︰1的。 |
相似问题
用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质) 这种颗粒可用如下氧化法提纯。(1)完成该反
用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯。(1)完成该反应的化学方程式:(系数按顺序填在答题卷上)___
在4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O的反应中 被还原的硝酸与未被还原的
在4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O的反应中,被还原的硝酸与未被还原的硝酸的物质的量比为()A.1∶9B.9∶1C.4∶2D.2∶4
将氯气通入一定温度的溶液中 得到含有次氯酸钾 氯酸钾和氯化钾的混合溶液。若反应过程中转移个电子 所得
将氯气通入一定温度的溶液中,得到含有次氯酸钾、氯酸钾和氯化钾的混合溶液。若反应过程中转移个电子,所得溶液中则参与反应的的物质的量为()A.B.C.D.
将适量的XeO3投入30mL 0.1 mol/L Mn2+的水溶液中 刚好完全反应。此时转移电子__
将适量的XeO3投入30mL 0 1 mol L Mn2+的水溶液中,刚好完全反应。此时转移电子_____________mol。将反应后的溶液稀释至90mL,所得溶液的pH=________。
抗击“非典”期间 过氧乙酸()是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取 所以在过氧乙酸中常
抗击“非典”期间,过氧乙酸()是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及












